

제약사가 의약품 개발 기술을 CDMO에 전달할 때, 연구진은 단순한 기술 전달 이상의 고민에 빠집니다. “CDMO가 이 기술의 맥락과 노하우까지 정확하게 이해할 수 있을까? 우리가 지켜온 기밀 사항들이 잘 유지될 수 있을까? 새로운 생산 환경에서도 동일한 결과를 재현할 수 있을까?”
기술 이전(Tech Transfer)이란 의약품을 개발한 제약사가 의약품의 제조 공정과 분석 시험법(=기술)을 CDMO에 전달하는 과정을 의미합니다. 단순히 문서와 공정을 공유하는 과정을 넘어 개발 과정에서 쌓인 수많은 시행착오와 데이터의 해석 방식, 공정에 깃든 철학까지 공유하는 과정이기도 합니다. 기술 이전 과정에서 겪을 수 있는 어려움과 의문들에 삼성바이오로직스가 답합니다.
* 이 글은 실제 삼성바이오로직스에서 진행했던 웨비나 참석자들의 질문을 바탕으로 구성하였습니다.
Q1. 고객사의 바이오의약품 공정을 그대로 재현하기 위해 어떤 시스템을 갖추고 있나요?
바이오의약품 특성과 품질의 일관성을 보장하는 기술 이전을 위해 삼성바이오로직스는 전사 표준 작업 절차(Standard Operating Procedure)를 운영, 기술 이전이 처음 논의되는 단계부터 실제 바이오의약품 생산까지의 전 과정을 표준화해 관리합니다.
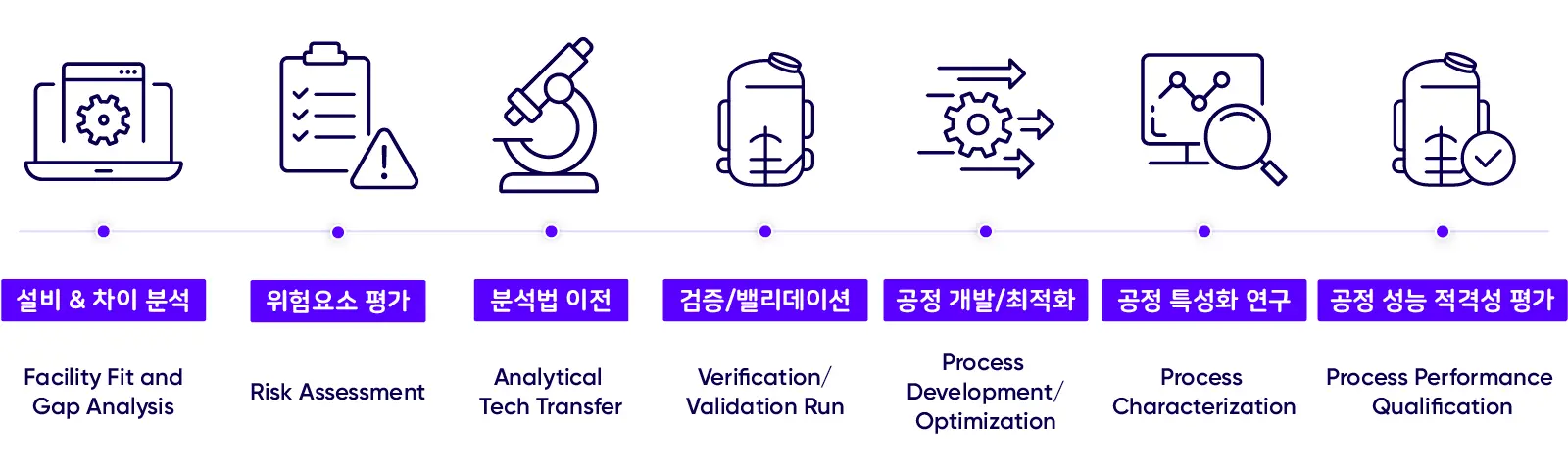
*삼성바이오로직스는 차이 분석(Gap Analysis)부터 공정 성능 적격성 평가(PPQ Process Performance Qualification)까지 기술이전 전 과정을 표준화해 의약품의 특성과 품질을 보장하고 있습니다.
기술 이전 과정에서 발생하는 모든 문서 양식을 표준화해 문서 작업의 효율성을 높이고, 고객사에게 더욱 정확한 정보를 투명하게 전달하고 있습니다.
Q2. 같은 원자재라도 생산지가 다르면 성능이 달라질 수 있는데, PPQ(Process validation) 단계에서 이런 공급 변동성까지 포함해 검증하는지 궁금합니다.
PPQ는 공정 검증(Process validation)의 한 과정으로, 기기, 설비, 원자재, 작업자의 자격 등 모든 공정 환경이 실제 생산에도 완벽하게 적용될 수 있는지 검증하는 단계입니다. 이때 기기, 설비, 원자재, 작업자 등 공정에 영향을 줄 수 다양한 변동 요인을 사전에 가정하고, 실사용 환경에서 동일한 품질이 유지되는지를 검증합니다.
일반적으로 PPQ를 수행할 때 공정에 사용될 수 있는 모든 대체 자재를 수급하지는 않습니다. 원자재는 위험도 평가(Risk Assessment)를 기반으로 사용 여부를 결정합니다. 공급사에서 제공한 데이터를 기반으로 모든 대체 자재를 PPQ에 사용하지 않더라도, 기존 공정과 동일한 결과를 보장하는 동등성(Equivalency)을 검증하면서 품질 리스크를 관리하고 있습니다.
Q3. 의약품 분석법의 개발∙적격성 평가(Qualification)∙검증(Validation)에 사용되는 분석 시료(Reagents) 이전도 기술 이전 과정에 포함되나요?
기술 이전 시 분석법 이전(Analytical Tech Transfer)을 함께 진행하기에, 분석 시료의 이전도 당연히 포함됩니다. 분석법 이전은 분석법 차이 평가(Analytical Gap Assessment)부터 시작하는데,
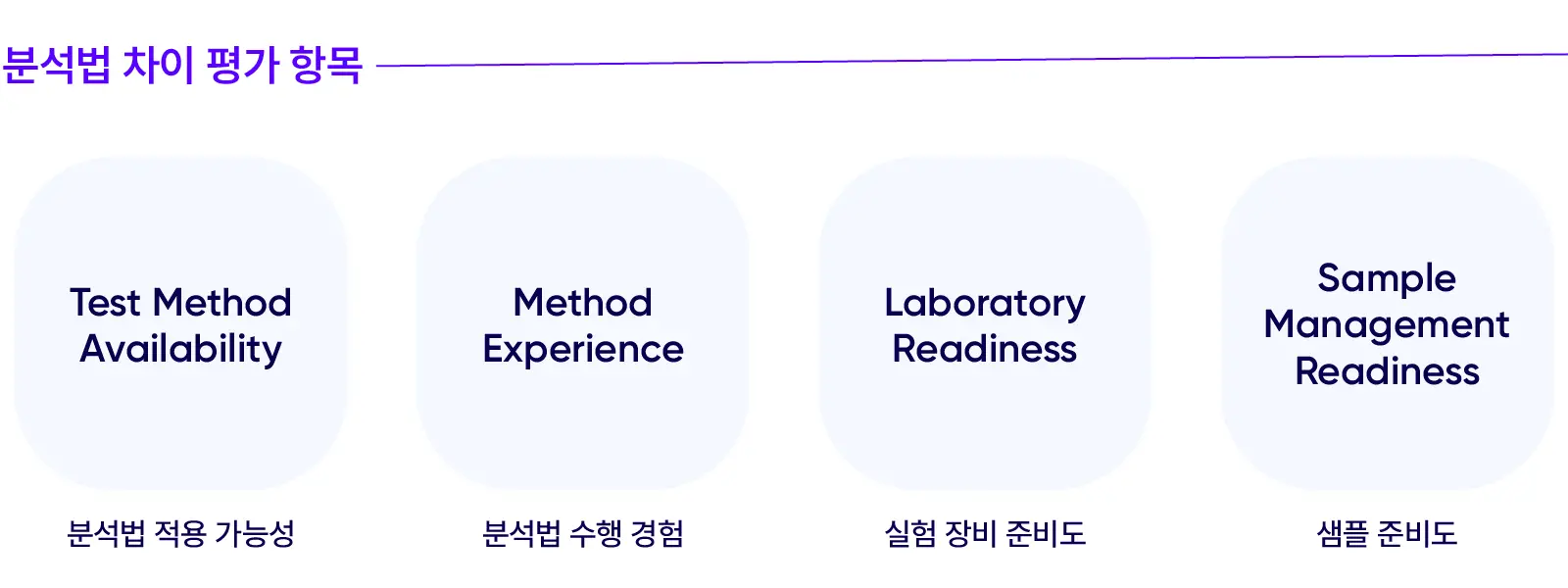
이때 분석 시료와 분석 소모품의 교체 또는 유지 여부가 결정됩니다. 분석법을 검증할 때 이러한 사항들을 명확하게 조율하면서 공정 지연 위험을 최소화하고, 생산 공정에 맞춰 분석 시험이 곧바로 진행될 수 있도록 선제적으로 분석 환경을 준비합니다.
Q4. 기술 이전 중 소규모 모델(Small-Scale Model)은 언제 구축하나요?
소규모 모델 구축은 GMP 환경에서의 대규모 생산에 앞서 진행됩니다. 소규모 모델로 CDMO 생산 현장의 공정 수행 능력을 미리 검증(Validation Run)하고, 필요에 따라 공정의 미세한 사항을 조정합니다.
이러한 사전 검증은 스케일 업(Scale-up) 진행 시 발생할 수 있는 문제를 조기에 예측하고 방지하는 데 매우 큰 역할을 합니다. 또한 소규모 모델 구축은 공정 특성화 연구(Process Characterization)나 바이러스 제거 연구(Viral Clearance) 결과가 대규모 생산에 적용 가능하도록 대표성을 갖추기 위한 필수 조건이기도 합니다.
Q5. 기술 이전에 소요되는 시간이 궁금합니다.
기술 이전에 소요되는 기간은 제품의 특성이나 개발 단계, 그리고 프로젝트를 수행하는 팀의 역량에 따라 달라집니다. 기술 이전을 전담하는 MSAT 팀 숙련도는 소규모에서 대규모에 이르는 다양한 규모의 생산 프로젝트 경험과 제품 수명 주기 속 여러 단계에서의 기술 이전 경험 보유 여부로 판단할 수 있습니다.
삼성바이오로직스는 다양한 조건의 생산 규모를 경험한 MSAT 팀의 전문성에 더해, 표준화된 시스템 아래 최적화된 설비 디자인과 운영 노하우를 갖추고 있습니다. 이에 높은 공정 재현성과 품질을 갖추고 규제 기관의 신뢰를 확보하며 최단 3개월이라는 성공적인 기술 이전 기록을 남기기도 했습니다.
Q6. 기술 이전에서 추가적인 공정 개발이 필요한 경우는 얼마나 되나요?
바이오의약품의 특성과 개발 단계에 따라 결정됩니다. 예를 들어 임상 시험을 목적으로 사용해 오던 바이오의약품을 대규모 생산을 목적으로 최초 확장할 때, 기술 이전 과정에서 일부 공정 조건을 조정할 가능성이 비교적 높습니다. 반면 이미 다른 생산 시설에서 대규모로 여러 차례 제조된 경험이 있는 허가된 바이오의약품이라면, 기존 공정의 변경 가능성은 낮은 편입니다.
Q7. 여러 생산 시설에서 기술 이전이 진행될 때도 공정과 품질이 동일하게 유지되나요?
삼성바이오로직스의 기술 이전은 최적화된 표준 모델 기반으로 공정과 품질의 일관성을 보장합니다. 모든 절차는 역할, 일정, 커뮤니케이션 체계에 따라 진행하고 있으며, 이는 공장 간 기술이전 시에도 동일하게 적용됩니다. 특히 모든 생산 시설이 동일한 설계 원칙, 장비 사양과 문서 시스템을 기반으로 운영되기 때문에 공장 간 기술 이전 시에도 재적격성 평가(Requalification)에 소요되는 시간을 최소화할 수 있는데, 이는 곧 신속한 프로젝트 진행을 의미합니다.
삼성바이오로직스는 최근 신규 CMO 브랜드 엑설런스(ExellenS™)를 공개하며 공장 간 동등성(Equivalency)와 속도(Speed)를 중심으로 하는 바이오의약품 생산의 새로운 표준을 제시했습니다. 엑설런스는 표준화(Standardization), 단순화(Simplification), 확장성(Scalability)을 핵심 원칙으로 일관성과 신뢰성을 더욱 강화합니다.
Q8. 기술 이전 기간을 단축하기 위해 어떤 디지털 전략을 사용하나요?
바이오의약품 제조 공정이 디지털 전환(Digitalization)을 거치면서 기술 이전 과정 또한 변화를 거듭하고 있습니다. 디지털 전환의 일환으로, 삼성바이오로직스는 고객사에 실시간으로 데이터를 공유하기 위한 ‘클라이언트 포털(Client Portal)’을 운영하며 보다 투명하고 효율적인 환경을 구축했습니다.
뿐만 아니라 다양한 프로젝트를 수행하며 축적한 경험을 기반으로, ‘Bioprocess Library’와 같은 중앙 데이터 저장소를 마련해 기술 이전 노하우와 지식을 보다 신속하게 검색해 실제 프로젝트에 적용할 수 있도록 지원하고 있습니다.
삼성바이오로직스는 체계적으로 구축된 디지털 플랫폼을 바탕으로 더욱 빠르고 정확한 의사 결정을 도우며, 더욱 신속하고 정밀한 기술 이전을 수행하고자 합니다.
Q9. 기술 이전 시 데이터를 주고받을 때, 보안 유지는 어떻게 진행되나요?
앞서 말한 클라이언트 포탈에서 모든 데이터가 공유되는데, 클라이언트 포털은 삼성 그룹의 기술력을 더한 철저한 보안 체계 아래 고객사와 전담 MSAT 팀 모두 개별 로그인을 통해 각각의 프로젝트에만 접근할 수 있도록 설계되어 있습니다.
삼성바이오로직스는 글로벌 CDMO 기업 중 유일하게 정보보호 인증인 ISO 27001과 ISO 27017을 동시에 보유하며 높은 수준의 정보보호 관리 체계로 고객사의 정보를 철저하게 관리합니다.
삼성바이오로직스는 원활한 스케일 업을 지원하며 기술 이전부터 원료 의약품,
완제 의약품 제조까지 엔드 투 엔드(End-to-End) 위탁 생산 서비스를 제공합니다.
높은 배치 성공률과 완벽한 품질 관리에 더해,
오랜 경험으로 다진 탁월한 전문성과 이유 있는 신속함.
☞ 삼성바이오로직스 기술 이전 전문가와 함께 더 많은 이야기를 나눠보세요.


제약사가 의약품 개발 기술을 CDMO에 전달할 때, 연구진은 단순한 기술 전달 이상의 고민에 빠집니다. “CDMO가 이 기술의 맥락과 노하우까지 정확하게 이해할 수 있을까? 우리가 지켜온 기밀 사항들이 잘 유지될 수 있을까? 새로운 생산 환경에서도 동일한 결과를 재현할 수 있을까?”
기술 이전(Tech Transfer)이란 의약품을 개발한 제약사가 의약품의 제조 공정과 분석 시험법(=기술)을 CDMO에 전달하는 과정을 의미합니다. 단순히 문서와 공정을 공유하는 과정을 넘어 개발 과정에서 쌓인 수많은 시행착오와 데이터의 해석 방식, 공정에 깃든 철학까지 공유하는 과정이기도 합니다. 기술 이전 과정에서 겪을 수 있는 어려움과 의문들에 삼성바이오로직스가 답합니다.
* 이 글은 실제 삼성바이오로직스에서 진행했던 웨비나 참석자들의 질문을 바탕으로 구성하였습니다.
Q1. 고객사의 바이오의약품 공정을 그대로 재현하기 위해 어떤 시스템을 갖추고 있나요?
바이오의약품 특성과 품질의 일관성을 보장하는 기술 이전을 위해 삼성바이오로직스는 전사 표준 작업 절차(Standard Operating Procedure)를 운영, 기술 이전이 처음 논의되는 단계부터 실제 바이오의약품 생산까지의 전 과정을 표준화해 관리합니다.
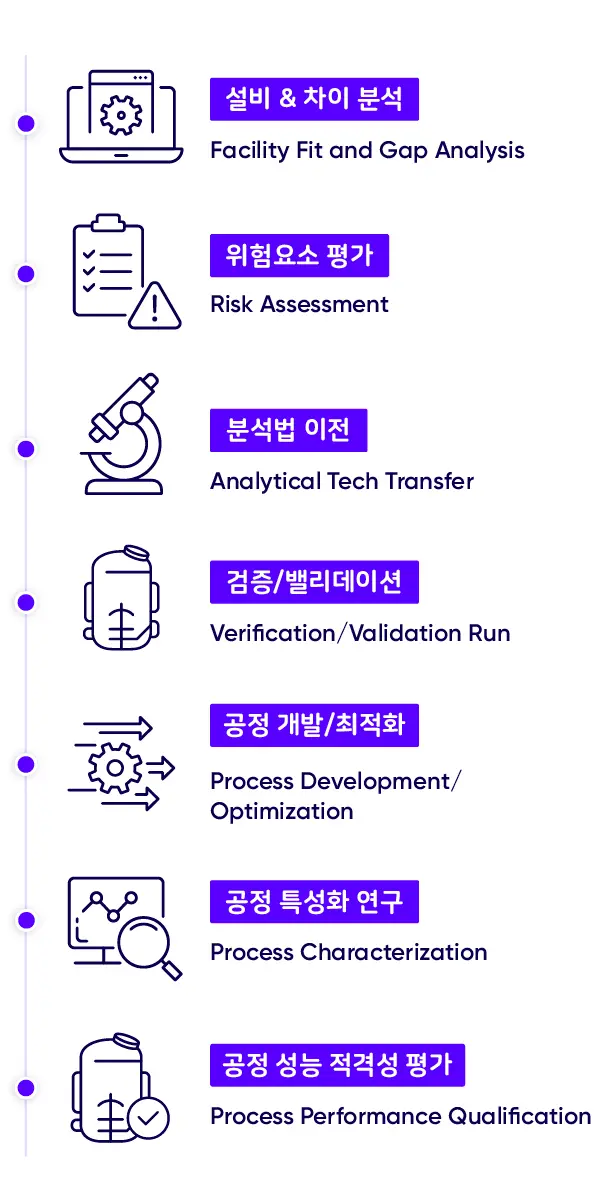
*삼성바이오로직스는 차이 분석(Gap Analysis)부터 공정 성능 적격성 평가(PPQ Process Performance Qualification)까지 기술이전 전 과정을 표준화해 의약품의 특성과 품질을 보장하고 있습니다.
기술 이전 과정에서 발생하는 모든 문서 양식을 표준화해 문서 작업의 효율성을 높이고, 고객사에게 더욱 정확한 정보를 투명하게 전달하고 있습니다.
Q2. 같은 원자재라도 생산지가 다르면 성능이 달라질 수 있는데, PPQ(Process validation) 단계에서 이런 공급 변동성까지 포함해 검증하는지 궁금합니다.
PPQ는 공정 검증(Process validation)의 한 과정으로, 기기, 설비, 원자재, 작업자의 자격 등 모든 공정 환경이 실제 생산에도 완벽하게 적용될 수 있는지 검증하는 단계입니다. 이때 기기, 설비, 원자재, 작업자 등 공정에 영향을 줄 수 다양한 변동 요인을 사전에 가정하고, 실사용 환경에서 동일한 품질이 유지되는지를 검증합니다.
일반적으로 PPQ를 수행할 때 공정에 사용될 수 있는 모든 대체 자재를 수급하지는 않습니다. 원자재는 위험도 평가(Risk Assessment)를 기반으로 사용 여부를 결정합니다. 공급사에서 제공한 데이터를 기반으로 모든 대체 자재를 PPQ에 사용하지 않더라도, 기존 공정과 동일한 결과를 보장하는 동등성(Equivalency)을 검증하면서 품질 리스크를 관리하고 있습니다.
Q3. 의약품 분석법의 개발∙적격성 평가(Qualification)∙검증(Validation)에 사용되는 분석 시료(Reagents) 이전도 기술 이전 과정에 포함되나요?
기술 이전 시 분석법 이전(Analytical Tech Transfer)을 함께 진행하기에, 분석 시료의 이전도 당연히 포함됩니다. 분석법 이전은 분석법 차이 평가(Analytical Gap Assessment)부터 시작하는데, 이때 분석 시료와 분석 소모품의 교체 또는 유지 여부가 결정됩니다.

분석법을 검증할 때 이러한 사항들을 명확하게 조율하면서 공정 지연 위험을 최소화하고, 생산 공정에 맞춰 분석 시험이 곧바로 진행될 수 있도록 선제적으로 분석 환경을 준비합니다.
Q4. 기술 이전 중 소규모 모델(Small-Scale Model)은 언제 구축하나요?
소규모 모델 구축은 GMP 환경에서의 대규모 생산에 앞서 진행됩니다. 소규모 모델로 CDMO 생산 현장의 공정 수행 능력을 미리 검증(Validation Run)하고, 필요에 따라 공정의 미세한 사항을 조정합니다.
이러한 사전 검증은 스케일 업(Scale-up) 진행 시 발생할 수 있는 문제를 조기에 예측하고 방지하는 데 매우 큰 역할을 합니다. 또한 소규모 모델 구축은 공정 특성화 연구(Process Characterization)나 바이러스 제거 연구(Viral Clearance) 결과가 대규모 생산에 적용 가능하도록 대표성을 갖추기 위한 필수 조건이기도 합니다.
Q5. 기술 이전에 소요되는 시간이 궁금합니다.
기술 이전에 소요되는 기간은 제품의 특성이나 개발 단계, 그리고 프로젝트를 수행하는 팀의 역량에 따라 달라집니다. 기술 이전을 전담하는 MSAT 팀 숙련도는 소규모에서 대규모에 이르는 다양한 규모의 생산 프로젝트 경험과 제품 수명 주기 속 여러 단계에서의 기술 이전 경험 보유 여부로 판단할 수 있습니다.
삼성바이오로직스는 다양한 조건의 생산 규모를 경험한 MSAT 팀의 전문성에 더해, 표준화된 시스템 아래 최적화된 설비 디자인과 운영 노하우를 갖추고 있습니다. 이에 높은 공정 재현성과 품질을 갖추고 규제 기관의 신뢰를 확보하며 최단 3개월이라는 성공적인 기술 이전 기록을 남기기도 했습니다.
Q6. 기술 이전에서 추가적인 공정 개발이 필요한 경우는 얼마나 되나요?
바이오의약품의 특성과 개발 단계에 따라 결정됩니다. 예를 들어 임상 시험을 목적으로 사용해 오던 바이오의약품을 대규모 생산을 목적으로 최초 확장할 때, 기술 이전 과정에서 일부 공정 조건을 조정할 가능성이 비교적 높습니다. 반면 이미 다른 생산 시설에서 대규모로 여러 차례 제조된 경험이 있는 허가된 바이오의약품이라면, 기존 공정의 변경 가능성은 낮은 편입니다.
Q7. 여러 생산 시설에서 기술 이전이 진행될 때도 공정과 품질이 동일하게 유지되나요?
삼성바이오로직스의 기술 이전은 최적화된 표준 모델 기반으로 공정과 품질의 일관성을 보장합니다. 모든 절차는 역할, 일정, 커뮤니케이션 체계에 따라 진행하고 있으며, 이는 공장 간 기술이전 시에도 동일하게 적용됩니다. 특히 모든 생산 시설이 동일한 설계 원칙, 장비 사양과 문서 시스템을 기반으로 운영되기 때문에 공장 간 기술 이전 시에도 재적격성 평가(Requalification)에 소요되는 시간을 최소화할 수 있는데, 이는 곧 신속한 프로젝트 진행을 의미합니다.
삼성바이오로직스는 최근 신규 CMO 브랜드 엑설런스(ExellenS™)를 공개하며 공장 간 동등성(Equivalency)와 속도(Speed)를 중심으로 하는 바이오의약품 생산의 새로운 표준을 제시했습니다. 엑설런스는 표준화(Standardization), 단순화(Simplification), 확장성(Scalability)을 핵심 원칙으로 일관성과 신뢰성을 더욱 강화합니다.
Q8. 기술 이전 기간을 단축하기 위해 어떤 디지털 전략을 사용하나요?
바이오의약품 제조 공정이 디지털 전환(Digitalization)을 거치면서 기술 이전 과정 또한 변화를 거듭하고 있습니다. 디지털 전환의 일환으로, 삼성바이오로직스는 고객사에 실시간으로 데이터를 공유하기 위한 ‘클라이언트 포털(Client Portal)’을 운영하며 보다 투명하고 효율적인 환경을 구축했습니다.
뿐만 아니라 다양한 프로젝트를 수행하며 축적한 경험을 기반으로, ‘Bioprocess Library’와 같은 중앙 데이터 저장소를 마련해 기술 이전 노하우와 지식을 보다 신속하게 검색해 실제 프로젝트에 적용할 수 있도록 지원하고 있습니다.
삼성바이오로직스는 체계적으로 구축된 디지털 플랫폼을 바탕으로 더욱 빠르고 정확한 의사 결정을 도우며, 더욱 신속하고 정밀한 기술 이전을 수행하고자 합니다.
Q9. 기술 이전 시 데이터를 주고받을 때, 보안 유지는 어떻게 진행되나요?
앞서 말한 클라이언트 포탈에서 모든 데이터가 공유되는데, 클라이언트 포털은 삼성 그룹의 기술력을 더한 철저한 보안 체계 아래 고객사와 전담 MSAT 팀 모두 개별 로그인을 통해 각각의 프로젝트에만 접근할 수 있도록 설계되어 있습니다.
삼성바이오로직스는 글로벌 CDMO 기업 중 유일하게 정보보호 인증인 ISO 27001과 ISO 27017을 동시에 보유하며 높은 수준의 정보보호 관리 체계로 고객사의 정보를 철저하게 관리합니다.
삼성바이오로직스는 원활한 스케일 업을 지원하며 기술 이전부터 원료 의약품, 완제 의약품 제조까지 엔드 투 엔드(End-to-End) 위탁 생산 서비스를 제공합니다.
높은 배치 성공률과 완벽한 품질 관리에 더해, 오랜 경험으로 다진 탁월한 전문성과 이유 있는 신속함.
Share article
Related Content