
한 글로벌 제약사는 유아용 호흡기 질환 치료제의 의약품 허가 신청을 위해 삼성바이오로직스를 찾았습니다. 해당 치료제는 특정 시기에 수요가 집중되는 만큼, 호흡기 질환이 증가하기 전에 의약품 승인 절차를 마무리하고 싶다는 조건이었습니다.
“호흡기 질환 치료 제는 호흡기 질환의 특성상 치료제의 효과가 특정 시점에 크게 좌우되는 의약품입니다. 일정이 지연될 경우 치료에 공백이 발생할 수 있기 때문에 공급이 필요한 때에 맞춰 제때에 허가 받는 일이 무엇보다 중요했죠. 특히 이 프로젝트는 빠듯한 일정 속에서 상업 규모의 시험생산(PPQ*) 이후 6개월 내 규제기관에 의약품 국제공통기술문서(CTD, Common Technical Document)를 제출해야 했습니다.”
제는 호흡기 질환의 특성상 치료제의 효과가 특정 시점에 크게 좌우되는 의약품입니다. 일정이 지연될 경우 치료에 공백이 발생할 수 있기 때문에 공급이 필요한 때에 맞춰 제때에 허가 받는 일이 무엇보다 중요했죠. 특히 이 프로젝트는 빠듯한 일정 속에서 상업 규모의 시험생산(PPQ*) 이후 6개월 내 규제기관에 의약품 국제공통기술문서(CTD, Common Technical Document)를 제출해야 했습니다.”
– 신호영 그룹장 (Regulatory Affairs(RA)그룹)
*PPQ(Process Performance Qualification): 상업 생산 전, 공정이 일관된 품질로 안정적으로 운영됨을 입증하기 위해 수행하는 검증 생산 단계
삼성바이오로직스 RA그룹은 바이오의약품이 품질 기준을 충족하며 일관되게 생산되는지, 또 이렇게 생산된 바이오의약품 품질이 어떻게 관리되는지를 데이터로 규제기관에 설명하고, 규제기관이 이 정보를 바탕으로 제품을 허가할 수 있도록 협의하는 다리 역할을 합니다.
특히 기술 이전부터 생산 공정 데이터에 이르기까지의 방대한 의약품 국제공통기술문서(CTD)를 짧은 기한 내 신속히 검토하기 위해서는 100명이 넘는 유관 부서의 전문성을 하나로 모아 체계적이고 효율적인 문서 리뷰 프로세스를 운영하는 것이 필요합니다.
당시 프로젝트에 참여한 김보미 프로(RA그룹)는 “허가 승인 성공의 출발점은 유관부서와의 공감대 형성이라고 생각했다”며 ‘일정을 맞추는 일이 왜 중요한지’, ‘이 과제가 환자에게 어떤 의미를 갖는지’를 모든 관련 부서와 이야기했다”고 당시를 회상했습니다.

“촉박한 일정으로 진행된 프로젝트인 만큼 일정 조율에 난관을 겪었습니다. 하지만 잠재적인 위험 요소를 사전에 감지하고, 작성 중인 문서에 포함될 원본 데이터(Raw Data)를 유관 부서에 미리 요청하는 등 허가 문서의 성격을 고려해 문서 작성과 리뷰를 병렬로 진행했습니다. 각 부서의 전문성을 바탕으로 투명하게 소통하는 협업 과정을 통해, 제한된 시간내 데이터 완전성(Data Integrity)을 준수하면서도 효율적인 리뷰를 마칠 수 있었어요.”
– 김보미 프로 (Regulatory Affairs(RA)그룹)
“프로젝트를 마친 뒤 고객사로부터 감사 인사(Thank You Letter)를 받았을 때, 그룹장님께서 ‘함께 고생한 모든 팀과 그 의미를 나누라’고 조언해 주신 적이 있습니다. 실제로 그 편지 내용을 유관 부서와 공유했는데, ‘공유해줘서 고맙다’, ‘내가 하는 일의 의미를 실감할 수 있었다’는 답장을 받았을 때 큰 보람을 느꼈습니다.”
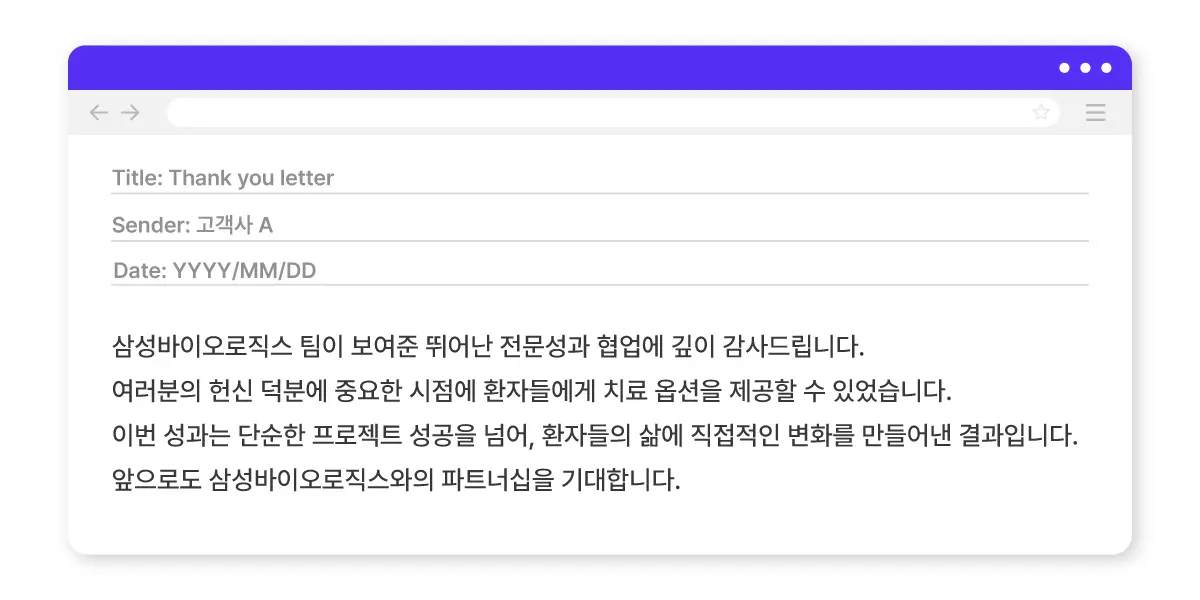 ▲ (연출 이미지) 프로젝트가 끝나고 고객사에서 보내온 감사 편지
▲ (연출 이미지) 프로젝트가 끝나고 고객사에서 보내온 감사 편지
안전하고 효과적인 고품질의 의약품이 환자에게 더 빠르게 전달되기 위해서는, 규제기관과의 신뢰 구축이 무엇보다 중요합니다. 삼성바이오로직스 RA그룹은 회사가 규제기관으로부터 신뢰할 수 있는 생산 시설로 인정받을 수 있도록, 규제 관점이 필요한 순간마다 다양한 유관 부서가 주저 없이 RA그룹과 의견을 나눌 수 있는 문화를 만들어가고 있습니다.

“매 프로젝트를 진행할 때마다 삼성바이오로직스의 모든 사람들은 ‘생명을 향한 의지(Driven. For Life.)’로 연결되어 있다는 느낌을 받아요. 더 건강한 삶이라는 하나의 지향점을 나침반 삼아 협업을 통해 빠르게 방향을 정해 나가는 것이 결국 고객 만족과 프로젝트 성공으로 이어지는 비결 아닐까요? 그 과정에서 RA그룹은 안전하고 효과적인 고품질 의약품이 환자에게 닿기까지 고객과 규제기관을 잇는 중간 다리 역할을 합니다. 우리가 다루는 일은 단지 문서가 아니라, 삶과 환자를 향한 따뜻한 마음을 연결하는 일이라 믿어요” (김보미 프로, RA그룹)

한 글로벌 제약사는 유아용 호흡기 질환 치료제의 의약품 허가 신청을 위해 삼성바이오로직스를 찾았습니다. 해당 치료제는 특정 시기에 수요가 집중되는 만큼, 호흡기 질환이 증가하기 전에 의약품 승인 절차를 마무리하고 싶다는 조건이었습니다.

“호흡기 질환 치료제는 호흡기 질환의 특성상 치료제의 효과가 특정 시점에 크게 좌우되는 의약품입니다. 일정이 지연될 경우 치료에 공백이 발생할 수 있기 때문에 공급이 필요한 때에 맞춰 제때에 허가 받는 일이 무엇보다 중요했죠. 특히 이 프로젝트는 빠듯한 일정 속에서 상업 규모의 시험생산(PPQ*) 이후 6개월 내 규제기관에 의약품 국제공통기술문서(CTD, Common Technical Document)를 제출해야 했습니다.”
– 신호영 그룹장 (Regulatory Affairs(RA)그룹)
*PPQ(Process Performance Qualification): 상업 생산 전, 공정이 일관된 품질로 안정적으로 운영됨을 입증하기 위해 수행하는 검증 생산 단계
삼성바이오로직스 RA그룹은 바이오의약품이 품질 기준을 충족하며 일관되게 생산되는지, 또 이렇게 생산된 바이오의약품 품질이 어떻게 관리되는지를 데이터로 규제기관에 설명하고, 규제기관이 이 정보를 바탕으로 제품을 허가할 수 있도록 협의하는 다리 역할을 합니다.
특히 기술 이전부터 생산 공정 데이터에 이르기까지의 방대한 의약품 국제공통기술문서(CTD)를 짧은 기한 내 신속히 검토하기 위해서는 100명이 넘는 유관 부서의 전문성을 하나로 모아 체계적이고 효율적인 문서 리뷰 프로세스를 운영하는 것이 필요합니다.
당시 프로젝트에 참여한 김보미 프로(RA그룹)는 “허가 승인 성공의 출발점은 유관부서와의 공감대 형성이라고 생각했다”며 ‘일정을 맞추는 일이 왜 중요한지’, ‘이 과제가 환자에게 어떤 의미를 갖는지’를 모든 관련 부서와 이야기했다”고 당시를 회상했습니다.

“촉박한 일정으로 진행된 프로젝트인 만큼 일정 조율에 난관을 겪었습니다. 하지만 잠재적인 위험 요소를 사전에 감지하고, 작성 중인 문서에 포함될 원본 데이터(Raw Data)를 유관 부서에 미리 요청하는 등 허가 문서의 성격을 고려해 문서 작성과 리뷰를 병렬로 진행했습니다. 각 부서의 전문성을 바탕으로 투명하게 소통하는 협업 과정을 통해, 제한된 시간내 데이터 완전성(Data Integrity)을 준수하면서도 효율적인 리뷰를 마칠 수 있었어요.”
– 김보미 프로 (Regulatory Affairs(RA)그룹)
“프로젝트를 마친 뒤 고객사로부터 감사 인사(Thank You Letter)를 받았을 때, 그룹장님께서 ‘함께 고생한 모든 팀과 그 의미를 나누라’고 조언해 주신 적이 있습니다. 실제로 그 편지 내용을 유관 부서와 공유했는데, ‘공유해줘서 고맙다’, ‘내가 하는 일의 의미를 실감할 수 있었다’는 답장을 받았을 때 큰 보람을 느꼈습니다.”
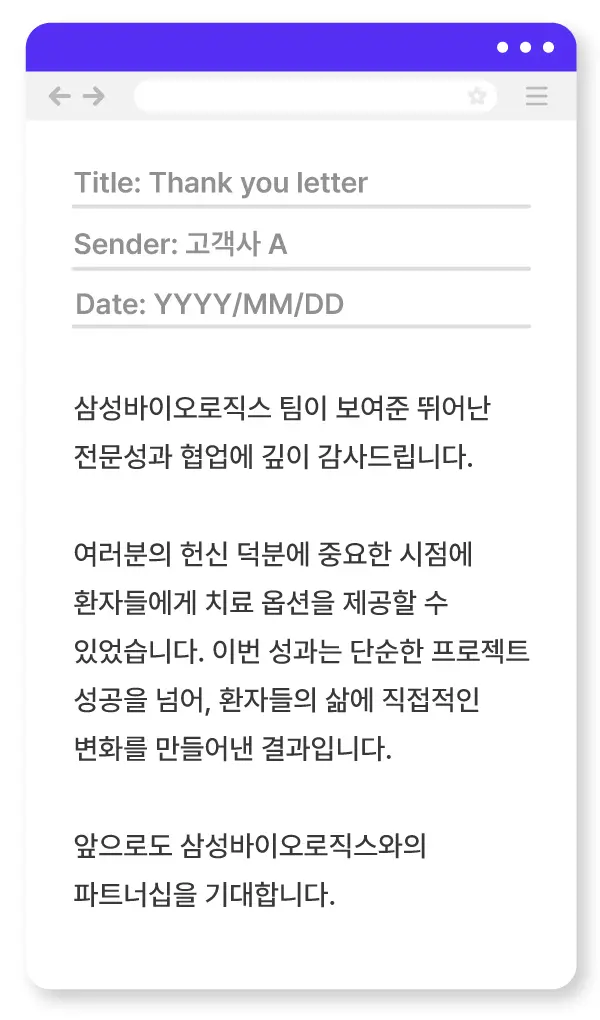 ▲ (연출 이미지) 프로젝트가 끝나고 고객사에서 보내온 감사 편지
▲ (연출 이미지) 프로젝트가 끝나고 고객사에서 보내온 감사 편지
안전하고 효과적인 고품질의 의약품이 환자에게 더 빠르게 전달되기 위해서는, 규제기관과의 신뢰 구축이 무엇보다 중요합니다. 삼성바이오로직스 RA그룹은 회사가 규제기관으로부터 신뢰할 수 있는 생산 시설로 인정받을 수 있도록, 규제 관점이 필요한 순간마다 다양한 유관 부서가 주저 없이 RA그룹과 의견을 나눌 수 있는 문화를 만들어가고 있습니다.

“매 프로젝트를 진행할 때마다 삼성바이오로직스의 모든 사람들은 ‘생명을 향한 의지(Driven. For Life.)’로 연결되어 있다는 느낌을 받아요. 더 건강한 삶이라는 하나의 지향점을 나침반 삼아 협업을 통해 빠르게 방향을 정해 나가는 것이 결국 고객 만족과 프로젝트 성공으로 이어지는 비결 아닐까요? 그 과정에서 RA그룹은 안전하고 효과적인 고품질 의약품이 환자에게 닿기까지 고객과 규제기관을 잇는 중간 다리 역할을 합니다. 우리가 다루는 일은 단지 문서가 아니라, 삶과 환자를 향한 따뜻한 마음을 연결하는 일이라 믿어요” (김보미 프로, RA그룹)
Share article
Related Content