

수 많은 생명을 살린 블록버스터 의약품도, 그 첫 시작은 검지손가락만한 튜브 속이었을 겁니다. 하나의 세포가 임상시험 후보 물질로 성장해 마침내 환자에게 투여되기까지, 의약품을 개발하다 보면 예상하지 못한 기술적 문제에 부딪히는 일이 빈번하게 발생합니다. 완벽해 보였던 세포주가 대량 배양 단계에서 단백질을 덜 만들거나, 개발 초기 단계에서 발견되지 않았던 불순물이 스케일 업(Scale-up) 과정에서 불쑥 튀어나오기도 합니다. 복잡한 의약품 개발 여정 속 연구원이라면 한 번쯤 겪었을 어려움과 의문들에 삼성바이오로직스가 답합니다.
* 이 글은 실제 삼성바이오로직스에서 진행했던 웨비나 참석자들의 질문을 바탕으로 구성하였습니다.

Q1. DEVELOPICK™ 데이터가 규제 기관 승인 심사에 어떤 도움을 줄 수 있나요?
DEVELOPICK™은 후기 발굴(Late Discovery) 단계에서 후보 물질의 잠재 리스크를 조기에 식별하고, 데이터 기반 인사이트를 제공해 후보 물질 선정 과정의 효율성을 극대화합니다. 데이터가 규제 기관에 직접 제출되지는 않지만, DEVELOPICK™을 통해 pH 민감성, 응집, 불안정성 등 주요 지표를 조기에 파악해 공정 및 제형 개발 과정의 주요 의사결정에 활용할 수 있습니다.
▶ DEVELOPICK 3.0 CASE 삼성바이오로직스는 프로젝트 초반 고객사 후보물질의 개발 가능성을 평가하던 중 낮은 pH 조건에서 매우 불안정한 특성을 보이는 분자를 발견하고, 단백질 분해를 방지하기 위해 기존 방식을 대체하는 바이러스 비활성화 정제 방법을 설계했습니다. DEVELOPICK™으로 위험 요인을 미리 파악했기에 개발 일정과 예산을 준수하며 무사히 임상 시험 단계에 진입할 수 있었습니다. 자세한 내용은 웨비나를 통해 확인해보세요. |
Q2. 후기 발굴 단계에서 후보 물질의 주요 특성은 어떻게 평가하는지 궁금합니다.
DEVELOPICK™은 80 mg 소량의 단백질로 DSF*, DLS*, SE-HPLC*, icIEF*와 같은 다양한 실험 기법을 사용해 열, 물리, 화학적 조건에 대한 후보물질의 안정성을 평가합니다. 동시에 개발 초기 단계에 컴퓨터 시뮬레이션과 데이터 분석을 통한 in silico 분석(서열 분석)으로 단백질의 1차 서열(아미노산 배열)을 파악해 응집(Aggregation), 탈아미드화(Deamidation), 산화(Oxidation), 단백질 절단(Cleavage)과 같은 위험 요인과 흡광계수, 등전점 등 기본적인 특성을 분석해 후속 개발 단계에서의 의사결정을 돕습니다.
의약품으로서의 대량 생산 가능성, 안전성과 유효성, 규제를 만족시킬 수 있는지 등 후보물질을 종합적으로 평가하는 일은 이후 개발 과정에서의 위험도를 낮추고, 더 적합한 후보에 자원을 집중하는 중요한 기반이 됩니다.
* DSF: Differential scanning Fluorimetry
* DLS: Dynamic light scattering
* SE-HPLC: Size exclusion-high performance liquid chromatography
* icIEF: Imaged capillary isoelectric focusing
▶ 삼성바이오로직스의 자체 개발 in silico 분석 프로그램 삼성바이오로직스는 자체 개발한 in silico 분석 프로그램과 내부 데이터를 활용해 개발 물질의 시퀀스 보안을 철저하게 유지합니다. 분자 실험 데이터베이스와 in silico 예측 결과를 비교해 후보물질의 개발 가능성을 정량적으로 평가할 수 있습니다. 자세한 내용은 웨비나를 통해 확인해보세요. |

Q1. 유전자를 삽입할 때, 전이 효소(Transposase) 시스템과
CRISPR-Cas9 방식의 차이점은 무엇인가요?
'유전자 삽입 방식'은 세포주 개발의 안정성에 영향을 미치는데, 현재 상업적으로 활용되는 방식으로는 크게 전이 효소(Transposase) 시스템과 CRISPR-Cas9 유전자 가위 방식이 있습니다.
전이 효소를 활용하면 관심 유전자(Gene of interest)를 전사 활성이 높은 부위에 10~15개, 많게는 20개까지 삽입할 수 있어 고발현 클론을 찾기 용이하고, 높은 수준의 단백질 발현량을 기대할 수 있습니다.
반면 CRISPR-Cas9 시스템은 지정된 위치(Locus)에 1~2개의 유전자를 정확하게 삽입합니다. 발현량은 낮은 편이지만 발현 수준과 클론 안정성을 보다 정확하게 예측할 수 있어 표준화된 생산성과 안정성 확보가 주 목적인 경우에 주로 활용됩니다.
Q2. S-AfuCHO™는 생산성과 안정성 측면에서 어떤 특징을 보이나요?
S-AfuCHO™는 다수의 클론에서 5g/L 이상의 안정적인 발현량을 유지했으며, 83%의 클론이 60번의 세포 분열 후에도 기존 대비 90% 이상의 생산성을 보였습니다.
S-AfuCHO™를 활용하면 99% 이상의 어퓨코실화 항체(Afuosylated Antibody)를 생산해 ADCC(Antibody-dependent cellular cytotoxicity, 항제의존세포독성) 효과를 높일 수 있습니다. 실제 내부 케이스 스터디에서 S-AfuCHO™로 생성한 후보 물질들이 기존 물질 대비 최대 10배 이상의 높은 ADCC 활성도를 나타냈습니다. 웨비나에서 실제 프로젝트 사례를 소개합니다.
Q3. 유전자 삽입 위치는 어떻게 선정하나요?
특정 DNA 염기 서열(TTAA)을 인식하는 전이 효소(Transposase) 시스템을 활용합니다. 전사 활성도가 가장 높은 삽입 부위를 찾아 유전자를 삽입하는 방식인데, 이 시스템을 활용하면 안정적이면서도 높은 수준의 발현량을 기대할 수 있습니다.
전이 효소 시스템을 활용한 S-AfuCHO™는 기존 S-CHOice® 세포주 대비 어퓨코실화(Afuosylated) 비율을 극대화해 항체의 ADCC 기능을 크게 높입니다.

Q1. 고농도 제형에서 도난 효과(Donnan effect)와 같은 문제들은 어떻게 해결하나요?
고농도 환경에서는 UF/DF(Ultrafiltration and diafiltration) 단계에서 도난 효과(Donnan effect)나 부피 배제 효과(Volume exclusion effect)로 인해 예상치 못한 pH 변화가 발생하기도 합니다. 삼성바이오로직스 제형개발팀은 pH 변화가 개발 초기 단계에서 어떻게 나타나는지 미리 측정해 버퍼(Buffer) 조성을 조정하는 등 최종 제형의 pH가 목표 수준에 도달하도록 선제적인 대응 전략을 설계합니다.
Q2. 첨가제(Excipient)나 계면활성제(Surfactant) 스크리닝은
어떤 방식으로 진행되나요?
후보 물질에 가장 적합한 계면활성제 탐색을 시작으로, 적정 pH 범위를 찾아내고 버퍼를 선택하는 실험을 거쳐 마지막으로 첨가제를 선별합니다. 후보 물질의 고유한 특성이나 고객사와의 협의에 따라 조정되기도 합니다.
Q3. 제형화 과정에서 물리적 안정성과 화학적 안정성을
모두 평가하는 것이 중요한 이유는 무엇인가요?
농도가 높아질수록 분자 간 상호작용이 활발해지면서 점도 상승, 응집, 용해도 저하와 같은 불안정성이 나타날 수 있는데, 이는 제형 품질에 직접적인 영향을 미치기 때문에 조기 평가 및 대응이 중요합니다.
또한 단백질은 pH, 온도, 첨가제 조성 등 다양한 변수에 민감하게 반응하기 때문에 단백질 자체의 기능적 특성뿐만 아니라 환경 요인에 따른 단백질 반응까지 포함한 다각적인 분석이 요구됩니다.
Q4. 고농도 바이오의약품에 특이적으로 필요한 첨가제(Excipient)가 있을까요?
대부분의 고농도 제형은 점도 조절제(Viscosity modifiers), 용해도 향상제(Solubility enhancers) 등 다양한 종류의 첨가제가 필요한 경우가 많습니다. 삼성바이오로직스 제형개발팀은 스크리닝 단계에서 각각의 첨가제가 주요 품질 특성에 미치는 영향을 평가하여 더욱 견고한 제형 설계를 지원합니다.
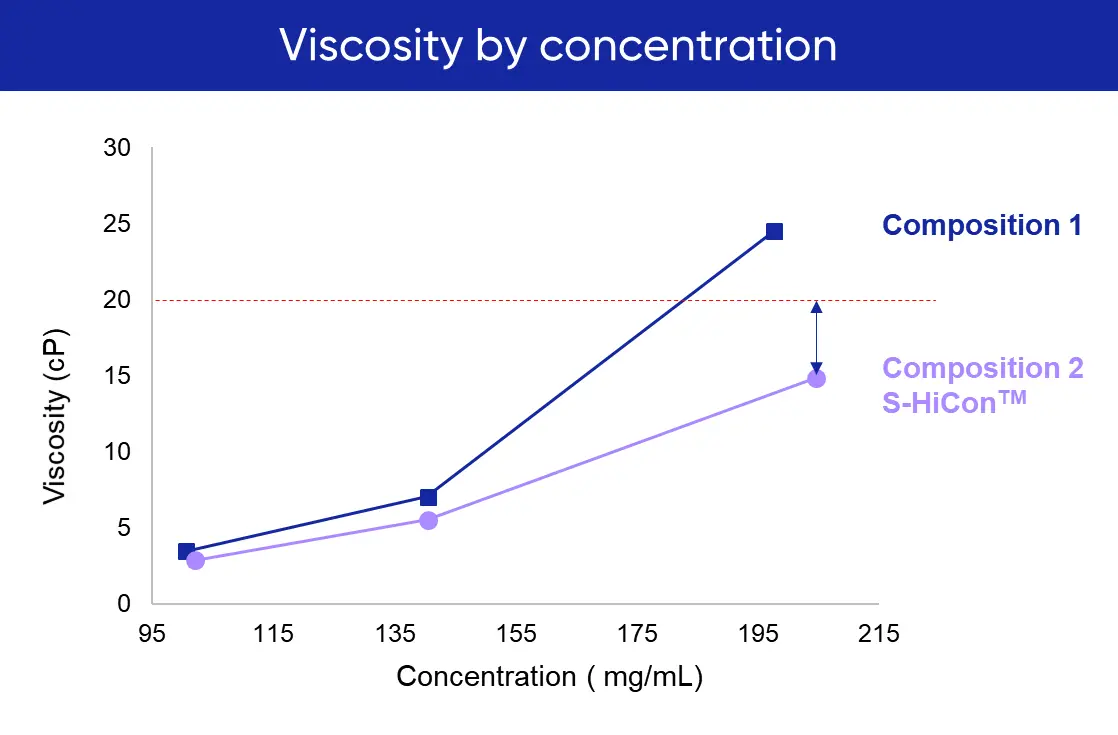
▶ S-HiCon™ 케이스 스터디 제형화 단계에서 S-HiCon™ 플랫폼을 활용한 단백질이 기존 단백질 대비 적정 점도 내에서 200mg/mL 이상의 높은 농도를 확보했습니다. 자세한 내용은 웨비나를 통해 확인해보세요. |

Q1. 성공적인 AMCQ(Analytical method co-qualification, 분석법 공동 자격화)
를 위해 고려해야할 주요 요인은 무엇일까요?
개발팀이 설계한 분석법을 품질팀으로 기술 이전하고, 검증까지 동시에 수행하는 분석법 공동 자격화(AMCQ, Analytical method co-qualification)는 개발 타임라인을 효과적으로 단축하는 전략 중 하나입니다.
효과적인 AMCQ를 구축하기 위해서는 품질 보증(Quality assurance), 품질 관리(Quality control), 개발팀 간의 유기적인 협업이 매우 중요합니다. 제대로 검증된 장비와 분석 전문가를 통해, 데이터의 보완성이 확보되었는지, 문서에 기반한 절차들이 일관적으로 준수되었는지, 유효기간 내 자재들이 문제없이 공급되어 사용되었는지 등의 다양한 고려 요인이 존재합니다.
Q2. AMCQ는 분석 품질 표준을 어떻게 유지하나요?
AMCQ 전략은 ICH* 분석 절차 검증 Q2(R2)에 기반해 체계적으로 설계되어 있습니다. 분석 품질 표준 유지를 위해서 개발 첫 단계부터 QRA(Quality risk assessment)를 통해 개발팀과 품질팀 간 운영 요소 격차를 분석합니다. 개발팀이 분석법 개발을 진행하는 동시에 품질팀은 ICH Q2(R2) 가이드라인에 따라 공정 변수 검증을 수행하는 등 명확한 역할이 규정되어야 합니다.
* ICH: 국제의약품규제조화위원회(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use)
Q3. AMCQ가 개발 타임라인과 대규모 생산 가능성에 미치는 영향은 무엇인가요?
삼성바이오로직스의 경우, 개발팀과 품질팀이 순차적으로 분석법 개발과 기술이전 및 검증을 수행할 때 평균 7.5개월이 소요된 반면, AMCQ 도입 이후 개발, 기술이전 및 검증까지의 기간을 4.5개월로 단축했습니다.
AMCQ가 대규모 생산 가능성에 직접적인 영향을 미친다고 보기는 어렵지만, 기술 이전 과정에서 운영 효율성을 크게 높일 수 있다는 데 의의가 있습니다. 생산 규모가 커지면서 관찰되는 분석 데이터의 차이는 AMCQ보다는 자재 변동성에 기인하는 경우가 많습니다.
Q4. AMCQ 도입 시 주요 리스크와 대응 방법이 궁금합니다.
AMCQ 도입 시 리스크는 주로 분석법의 개발, 기술 이전, 검증 등 각 단계에서 사용되는 자재가 서로 다를 경우 발생합니다. 각 과정에서 서로 다른 시료를 사용할 경우 단백질의 접힘 구조나 안정성에 차이가 발생할 수 있기에, AMCQ가 원활하게 진행되기 위해서는 모두 동일한 물질을 사용하는 것이 이상적입니다. 만약 공급망 이슈로 모든 단계에서 100% 일치하는 자재를 사용할 수 없을 경우 공정을 대표할 물질 또는 GMP 환경에서 적용 가능한 자재로만 선별하여 사용할 것을 권장하고 있습니다.
특히 단백질의 접힘 구조나 단백질 활성 자체에 영향을 주는 전하 분석법(Charge-related methods)은 기술 이전 시 명확한 커뮤니케이션과 공정 조율을 거쳐 문제를 사전에 예방하는 것이 중요합니다.
Q5. AMCQ 도입의 장점은 무엇인가요?
분석법 기술이전 과정에서 발생할 수 있는 분석 조건 해석의 차이나 실험 수행 방식의 차이를 최소화하면서 개발 일정 전반을 단축할 수 있다는 점, 그리고 대규모 GMP 생산 시 필요한 분석 시험을 미리 준비할 수 있다는 점입니다.
성공적인 신약 개발 과정을 함께하는 든든한 위탁 개발 파트너.
삼성바이오로직스는 개발 전문성과 고객 중심 마인드로 최적화된 맞춤 서비스를 제공해
빠르고 효율적으로 신약 개발을 지원합니다.
물질에 대한 깊은 이해와 개발 노하우, 자체 보유 플랫폼을 활용해 개발 과정에서의 위험 요소를 최소화하고, 고객의 의약품 개발 전략에 맞춘 유연한 접근으로 최적화된 타임라인을 제시합니다.
☞ 삼성바이오로직스 위탁개발(CDO) 전문가와 함께 더 많은 이야기를 나눠보세요.


수 많은 생명을 살린 블록버스터 의약품도, 그 첫 시작은 검지손가락만한 튜브 속이었을 겁니다. 하나의 세포가 임상시험 후보 물질로 성장해 마침내 환자에게 투여되기까지, 의약품을 개발하다 보면 예상하지 못한 기술적 문제에 부딪히는 일이 빈번하게 발생합니다. 완벽해 보였던 세포주가 대량 배양 단계에서 단백질을 덜 만들거나, 개발 초기 단계에서 발견되지 않았던 불순물이 스케일 업(Scale-up) 과정에서 불쑥 튀어나오기도 합니다. 복잡한 의약품 개발 여정 속 연구원이라면 한 번쯤 겪었을 어려움과 의문들에 삼성바이오로직스가 답합니다.
* 이 글은 실제 삼성바이오로직스에서 진행했던 웨비나 참석자들의 질문을 바탕으로 구성하였습니다.

Q1. DEVELOPICK™ 데이터가 규제 기관 승인 심사에 어떤 도움을 줄 수 있나요?
DEVELOPICK™은 후기 발굴(Late Discovery) 단계에서 후보 물질의 잠재 리스크를 조기에 식별하고, 데이터 기반 인사이트를 제공해 후보 물질 선정 과정의 효율성을 극대화합니다. 데이터가 규제 기관에 직접 제출되지는 않지만, DEVELOPICK™을 통해 pH 민감성, 응집, 불안정성 등 주요 지표를 조기에 파악해 공정 및 제형 개발 과정의 주요 의사결정에 활용할 수 있습니다.
▶ DEVELOPICK 3.0 CASE 삼성바이오로직스는 프로젝트 초반 고객사 후보물질의 개발 가능성을 평가하던 중 낮은 pH 조건에서 매우 불안정한 특성을 보이는 분자를 발견하고, 단백질 분해를 방지하기 위해 기존 방식을 대체하는 바이러스 비활성화 정제 방법을 설계했습니다. DEVELOPICK™으로 위험 요인을 미리 파악했기에 개발 일정과 예산을 준수하며 무사히 임상 시험 단계에 진입할 수 있었습니다. 자세한 내용은 웨비나를 통해 확인해보세요. |
Q2. 후기 발굴 단계에서 후보 물질의 주요 특성은 어떻게 평가하는지 궁금합니다.
DEVELOPICK™은 80 mg 소량의 단백질로 DSF*, DLS*, SE-HPLC*, icIEF*와 같은 다양한 실험 기법을 사용해 열, 물리, 화학적 조건에 대한 후보물질의 안정성을 평가합니다. 동시에 개발 초기 단계에 컴퓨터 시뮬레이션과 데이터 분석을 통한 in silico 분석(서열 분석)으로 단백질의 1차 서열(아미노산 배열)을 파악해 응집(Aggregation), 탈아미드화(Deamidation), 산화(Oxidation), 단백질 절단(Cleavage)과 같은 위험 요인과 흡광계수, 등전점 등 기본적인 특성을 분석해 후속 개발 단계에서의 의사결정을 돕습니다.
의약품으로서의 대량 생산 가능성, 안전성과 유효성, 규제를 만족시킬 수 있는지 등 후보물질을 종합적으로 평가하는 일은 이후 개발 과정에서의 위험도를 낮추고, 더 적합한 후보에 자원을 집중하는 중요한 기반이 됩니다.
* DSF: Differential scanning Fluorimetry
* DLS: Dynamic light scattering
* SE-HPLC: Size exclusion-high performance liquid chromatography
* icIEF: Imaged capillary isoelectric focusing
▶ 삼성바이오로직스의 자체 개발 in silico 분석 프로그램 삼성바이오로직스는 자체 개발한 in silico 분석 프로그램과 내부 데이터를 활용해 개발 물질의 시퀀스 보안을 철저하게 유지합니다. 분자 실험 데이터베이스와 in silico 예측 결과를 비교해 후보물질의 개발 가능성을 정량적으로 평가할 수 있습니다. 자세한 내용은 웨비나를 통해 확인해보세요. |

Q1. 유전자를 삽입할 때, 전이 효소(Transposase) 시스템과 CRISPR-Cas9 방식의 차이점은 무엇인가요?
'유전자 삽입 방식'은 세포주 개발의 안정성에 영향을 미치는데, 현재 상업적으로 활용되는 방식으로는 크게 전이 효소(Transposase) 시스템과 CRISPR-Cas9 유전자 가위 방식이 있습니다.
전이 효소를 활용하면 관심 유전자(Gene of interest)를 전사 활성이 높은 부위에 10~15개, 많게는 20개까지 삽입할 수 있어 고발현 클론을 찾기 용이하고, 높은 수준의 단백질 발현량을 기대할 수 있습니다.
반면 CRISPR-Cas9 시스템은 지정된 위치(Locus)에 1~2개의 유전자를 정확하게 삽입합니다. 발현량은 낮은 편이지만 발현 수준과 클론 안정성을 보다 정확하게 예측할 수 있어 표준화된 생산성과 안정성 확보가 주 목적인 경우에 주로 활용됩니다.
Q2. S-AfuCHO™는 생산성과 안정성 측면에서 어떤 특징을 보이나요?
S-AfuCHO™는 다수의 클론에서 5g/L 이상의 안정적인 발현량을 유지했으며, 83%의 클론이 60번의 세포 분열 후에도 기존 대비 90% 이상의 생산성을 보였습니다.
S-AfuCHO™를 활용하면 99% 이상의 어퓨코실화 항체(Afuosylated Antibody)를 생산해 ADCC(Antibody-dependent cellular cytotoxicity, 항제의존세포독성) 효과를 높일 수 있습니다. 실제 내부 케이스 스터디에서 S-AfuCHO™로 생성한 후보 물질들이 기존 물질 대비 최대 10배 이상의 높은 ADCC 활성도를 나타냈습니다. 웨비나에서 실제 프로젝트 사례를 소개합니다.
Q3. 유전자 삽입 위치는 어떻게 선정하나요?
특정 DNA 염기 서열(TTAA)을 인식하는 전이 효소(Transposase) 시스템을 활용합니다. 전사 활성도가 가장 높은 삽입 부위를 찾아 유전자를 삽입하는 방식인데, 이 시스템을 활용하면 안정적이면서도 높은 수준의 발현량을 기대할 수 있습니다.
전이 효소 시스템을 활용한 S-AfuCHO™는 기존 S-CHOice® 세포주 대비 어퓨코실화(Afuosylated) 비율을 극대화해 항체의 ADCC 기능을 크게 높입니다.

Q1. 고농도 제형에서 도난 효과(Donnan effect)와 같은 문제들은 어떻게 해결하나요?
고농도 환경에서는 UF/DF(Ultrafiltration and diafiltration) 단계에서 도난 효과(Donnan effect)나 부피 배제 효과(Volume exclusion effect)로 인해 예상치 못한 pH 변화가 발생하기도 합니다. 삼성바이오로직스 제형개발팀은 pH 변화가 개발 초기 단계에서 어떻게 나타나는지 미리 측정해 버퍼(Buffer) 조성을 조정하는 등 최종 제형의 pH가 목표 수준에 도달하도록 선제적인 대응 전략을 설계합니다.
Q2. 첨가제(Excipient)나 계면활성제(Surfactant) 스크리닝은 어떤 방식으로 진행되나요?
후보 물질에 가장 적합한 계면활성제 탐색을 시작으로, 적정 pH 범위를 찾아내고 버퍼를 선택하는 실험을 거쳐 마지막으로 첨가제를 선별합니다. 후보 물질의 고유한 특성이나 고객사와의 협의에 따라 조정되기도 합니다.
Q3. 제형화 과정에서 물리적 안정성과 화학적 안정성을 모두 평가하는 것이 중요한 이유는 무엇인가요?
농도가 높아질수록 분자 간 상호작용이 활발해지면서 점도 상승, 응집, 용해도 저하와 같은 불안정성이 나타날 수 있는데, 이는 제형 품질에 직접적인 영향을 미치기 때문에 조기 평가 및 대응이 중요합니다. 또한 단백질은 pH, 온도, 첨가제 조성 등 다양한 변수에 민감하게 반응하기 때문에 단백질 자체의 기능적 특성뿐만 아니라 환경 요인에 따른 단백질 반응까지 포함한 다각적인 분석이 요구됩니다.
Q4. 고농도 바이오의약품에 특이적으로 필요한 첨가제(Excipient)가 있을까요?
대부분의 고농도 제형은 점도 조절제(Viscosity modifiers), 용해도 향상제(Solubility enhancers) 등 다양한 종류의 첨가제가 필요한 경우가 많습니다. 삼성바이오로직스 제형개발팀은 스크리닝 단계에서 각각의 첨가제가 주요 품질 특성에 미치는 영향을 평가하여 더욱 견고한 제형 설계를 지원합니다.

▶ S-HiCon™ 케이스 스터디 제형화 단계에서 S-HiCon™ 플랫폼을 활용한 단백질이 기존 단백질 대비 적정 점도 내에서 200mg/mL 이상의 높은 농도를 확보했습니다. 자세한 내용은 웨비나를 통해 확인해보세요. |

Q1. 성공적인 AMCQ(Analytical method co-qualification, 분석법 공동 자격화)를 위해 고려해야할 주요 요인은 무엇일까요?
개발팀이 설계한 분석법을 품질팀으로 기술 이전하고, 검증까지 동시에 수행하는 분석법 공동 자격화(AMCQ, Analytical method co-qualification)는 개발 타임라인을 효과적으로 단축하는 전략 중 하나입니다.
효과적인 AMCQ를 구축하기 위해서는 품질 보증(Quality assurance), 품질 관리(Quality control), 개발팀 간의 유기적인 협업이 매우 중요합니다. 제대로 검증된 장비와 분석 전문가를 통해, 데이터의 보완성이 확보되었는지, 문서에 기반한 절차들이 일관적으로 준수되었는지, 유효기간 내 자재들이 문제없이 공급되어 사용되었는지 등의 다양한 고려 요인이 존재합니다.
Q2. AMCQ는 분석 품질 표준을 어떻게 유지하나요?
AMCQ 전략은 ICH* 분석 절차 검증 Q2(R2)에 기반해 체계적으로 설계되어 있습니다. 분석 품질 표준 유지를 위해서 개발 첫 단계부터 QRA(Quality risk assessment)를 통해 개발팀과 품질팀 간 운영 요소 격차를 분석합니다. 개발팀이 분석법 개발을 진행하는 동시에 품질팀은 ICH Q2(R2) 가이드라인에 따라 공정 변수 검증을 수행하는 등 명확한 역할이 규정되어야 합니다.
* ICH: 국제의약품규제조화위원회(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use)
Q3. AMCQ가 개발 타임라인과 대규모 생산 가능성에 미치는 영향은 무엇인가요?
삼성바이오로직스의 경우, 개발팀과 품질팀이 순차적으로 분석법 개발과 기술이전 및 검증을 수행할 때 평균 7.5개월이 소요된 반면, AMCQ 도입 이후 개발, 기술이전 및 검증까지의 기간을 4.5개월로 단축했습니다.
AMCQ가 대규모 생산 가능성에 직접적인 영향을 미친다고 보기는 어렵지만, 기술 이전 과정에서 운영 효율성을 크게 높일 수 있다는 데 의의가 있습니다. 생산 규모가 커지면서 관찰되는 분석 데이터의 차이는 AMCQ보다는 자재 변동성에 기인하는 경우가 많습니다.
Q4. AMCQ 도입 시 주요 리스크와 대응 방법이 궁금합니다.
AMCQ 도입 시 리스크는 주로 분석법의 개발, 기술 이전, 검증 등 각 단계에서 사용되는 자재가 서로 다를 경우 발생합니다. 각 과정에서 서로 다른 시료를 사용할 경우 단백질의 접힘 구조나 안정성에 차이가 발생할 수 있기에, AMCQ가 원활하게 진행되기 위해서는 모두 동일한 물질을 사용하는 것이 이상적입니다. 만약 공급망 이슈로 모든 단계에서 100% 일치하는 자재를 사용할 수 없을 경우 공정을 대표할 물질 또는 GMP 환경에서 적용 가능한 자재로만 선별하여 사용할 것을 권장하고 있습니다.
특히 단백질의 접힘 구조나 단백질 활성 자체에 영향을 주는 전하 분석법(Charge-related methods)은 기술 이전 시 명확한 커뮤니케이션과 공정 조율을 거쳐 문제를 사전에 예방하는 것이 중요합니다.
Q5. AMCQ 도입의 장점은 무엇인가요?
분석법 기술이전 과정에서 발생할 수 있는 분석 조건 해석의 차이나 실험 수행 방식의 차이를 최소화하면서 개발 일정 전반을 단축할 수 있다는 점, 그리고 대규모 GMP 생산 시 필요한 분석 시험을 미리 준비할 수 있다는 점입니다.
성공적인 신약 개발 과정을 함께하는 든든한 위탁 개발 파트너.
삼성바이오로직스는 개발 전문성과 고객 중심 마인드로 최적화된 맞춤 서비스를 제공해 빠르고 효율적으로 신약 개발을 지원합니다.
물질에 대한 깊은 이해와 개발 노하우, 자체 보유 플랫폼을 활용해 개발 과정에서의 위험 요소를 최소화하고, 고객의 의약품 개발 전략에 맞춘 유연한 접근으로 최적화된 타임라인을 제시합니다.
☞ 삼성바이오로직스 위탁개발(CDO) 전문가와 함께 더 많은 이야기를 나눠보세요.
Share article
Related Content