
삼성바이오로직스는 UCB, MSD, 일라이 릴리(Eli Lilly) 등 글로벌 빅파마와 잇따라 바이오의약품 위탁생산(CMO) 수주를 확대, 올해 상반기에만 약 7,927억원의 추가 계약을 진행했다고 밝혔습니다. 파트너십이 체결되면 본격적인 바이오의약품 생산을 위한 ‘기술 이전(Technology Transfer)’ 단계로 접어들게 되는데, 삼성바이오로직스는 기술 이전 기간을 업계 평균 절반 수준인 3개월로 단축시키기도 했습니다. 글로벌 빅파마를 사로잡은 이유 있는 ‘신속함’. 삼성바이오로직스의 기술 이전 경쟁력을 살펴봅니다.
리스크 ‘제로(0)’를 향한 ‘동기화’ 과정
기술 이전이란 제약사가 개발한 바이오의약품의 제조 공정, 분석/시험 방법을 삼성바이오로직스로 전달하는 일련의 과정을 말합니다. 제약사의 바이오의약품을 삼성바이오로직스에서 생산할 때도 의약품의 특성과 품질이 일정하도록 만드는 것이 핵심으로, 제약사와 ‘동기화’ 하는 과정인 셈입니다.

- 설치 차이 분석 Facility Fit and Gap Analysis
- 위험요소 평가 Risk Assessment
- 분석법 이전 Analytical Tech Transfer
- 검증/밸리데이션 Verification / Validation Run
- 공정 개발/최적화 Process Development/ Optimization
- 공정 특성화 연구 Process Characterization
- 공정 성능 적격성 Process Performance Qualification
원활한 동기화를 위해서는 먼저 ‘차이 분석(Gap Analysis)’이 필요합니다. 생산 설비, 공정 절차, 사용하는 원료 등 의약품 생산현장의 온도부터 공정별 소요시간까지 약 180가지 이상의 요소를 다각적으로 분석하는데, 이렇게 파악한 모든 차이는 문서로 기록되어 기술 이전 절차의 뼈대가 됩니다. 제약사와 CDMO간 설비 옵션의 간극이 크면 새로운 설비를 도입하기도 하고, 초기에 필요한 원자재를 신속하게 조달해 리드타임을 최소화하기도 하죠.
이후 위험요소 평가, 분석법 이전, 검증/밸리데이션 운전, 공정 특성화 연구를 거쳐, 총 4차례 이상의 공정 성능 적격성 평가까지 통과하면 본격적인 상업 생산에 도입할 청사진이 완성됩니다.
이유 있는 신속함, 시스템과 프로세스 혁신
제약사가 위탁한 바이오의약품을 시장에 빠르게 출시하기 위해서는 기술 이전 단계부터 상업 생산 단계까지 모든 과정을 감안해 계획을 수립하고 위험요소를 철저하게 관리해야 합니다.
삼성바이오로직스는 단일 사이트 기준 세계 최대 규모의 항체 기반 바이오의약품 생산 시설에서 100여개 넘는 전세계 고객사와 함께 프로젝트를 진행하며 축적한 생산 노하우를 기반으로 기술이전 절차를 표준화 했습니다. 특히 삼성바이오로직스의 ‘품질 위험요소 관리 시스템(Quality Risk Management System)’에 따라 모든 위험요소를 점수로 집계하는데, 일정 점수 이상의 고위험군으로 판단되면 전담팀을 추가로 구성합니다. 기술 이전에 영향을 미칠 수 있는 위험요소를 미리 찾아 체계적으로 관리하는 것이죠.

또한 FDA, EMA 외 각국 규제기관의 다양한 품질 기준을 맞추면서 쌓은 전문성으로 최신 규제 동향을 반영한 전략을 제시하고, 고객 맞춤형 추가 연구 옵션인 ‘프리미엄 애드온(add-on) 서비스’ 도입, 데이터 관리를 위한 디지털 기술 접목 등 프로세스 혁신을 이어가고 있습니다.
데이터 보호, 기술 이전의 핵심으로 부상
한편, 기술 이전 과정에서는 영업 비밀이나 환자 데이터 등과 같은 주요 정보가 다뤄지는 만큼 신속한 기술 이전의 핵심 요소로 ‘정보 보호’가 부상하고 있습니다. 미국 보건복지부(HHS)가 발표한 바이오 기업의 사이버위협 관련 보고서에 따르면 헬스케어 분야의 사이버 위협은 전체 해킹의 24.5%를 차지하며, 데이터 유출로 인한 평균 손해 비용은 500만 달러(약 68억)원에 달합니다.
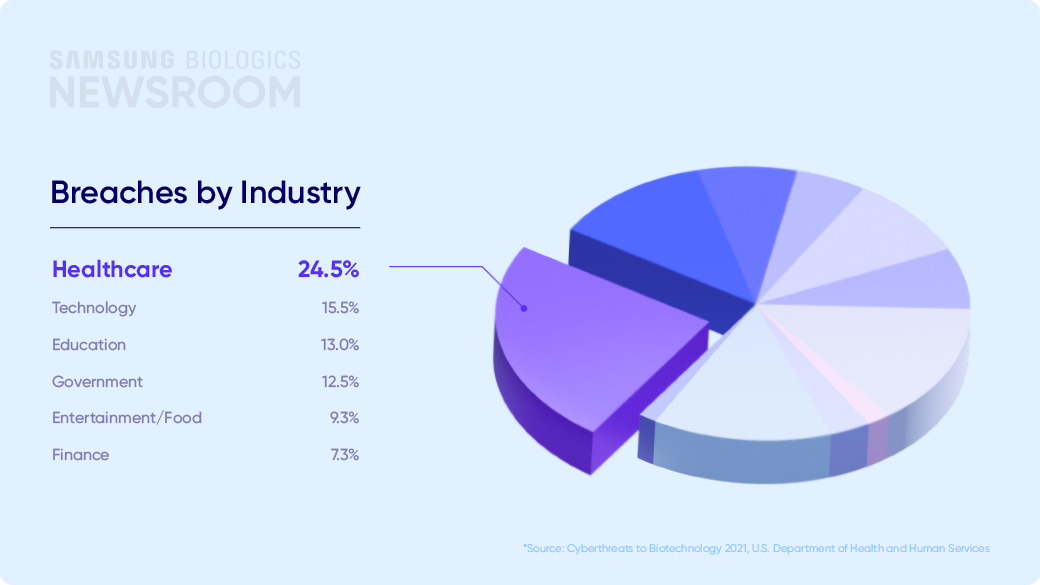
Breaches by Industry
- Healthcare 24.5%
- Technology 15.5%
- Education 13.0%
- Government 12.5%
- Entertainment/Food 9.3%
- Finance 7.3%
삼성바이오로직스는 CDMO 기업 최초로 지난 2019년 정보보호 국제표준 인증인 ISO 27001을 획득한 데 이어, 2022년에는 ISO 27017(클라우드 보안) 인증을 추가 획득하며 글로벌 최고 수준의 보안관리체계를 갖추고 지적 재산권과 데이터 보호에 힘쓰고 있습니다.
바이오 업계의 성장에 따라 사이버 보안 이슈가 증가하고, 각국 정부와 글로벌 규제기관의 데이터 보호 기조가 강화되면서 사이버 보안과 정보 보호 관련 기준도 갈수록 심화될 것으로 예측됩니다.
완벽함에 신속함을 더하는, 이유 있는 신뢰 관계.
삼성바이오로직스의 기술 이전 노하우를 더 자세히 알고 싶다면, 다음 백서를 확인해보세요. 😊
관련 콘텐츠
Whitepapers Streamlining single-use assemblies in the bulk-fill step of downstream processing
Samsung BIO Insight 글로벌 빅파마와의 파트너십, 세계 최대 생산시설에서 신뢰를 스케일업(Scale Up)하다

삼성바이오로직스는 UCB, MSD, 일라이 릴리(Eli Lilly) 등 글로벌 빅파마와 잇따라 바이오의약품 위탁생산(CMO) 수주를 확대, 올해 상반기에만 약 7,927억원의 추가 계약을 진행했다고 밝혔습니다. 파트너십이 체결되면 본격적인 바이오의약품 생산을 위한 ‘기술 이전(Technology Transfer)’ 단계로 접어들게 되는데, 삼성바이오로직스는 기술 이전 기간을 업계 평균 절반 수준인 3개월로 단축시키기도 했습니다. 글로벌 빅파마를 사로잡은 이유 있는 ‘신속함’. 삼성바이오로직스의 기술 이전 경쟁력을 살펴봅니다.
리스크 ‘제로(0)’를 향한 ‘동기화’ 과정
기술 이전이란 제약사가 개발한 바이오의약품의 제조 공정, 분석/시험 방법을 삼성바이오로직스로 전달하는 일련의 과정을 말합니다. 제약사의 바이오의약품을 삼성바이오로직스에서 생산할 때도 의약품의 특성과 품질이 일정하도록 만드는 것이 핵심으로, 제약사와 ‘동기화’ 하는 과정인 셈입니다.
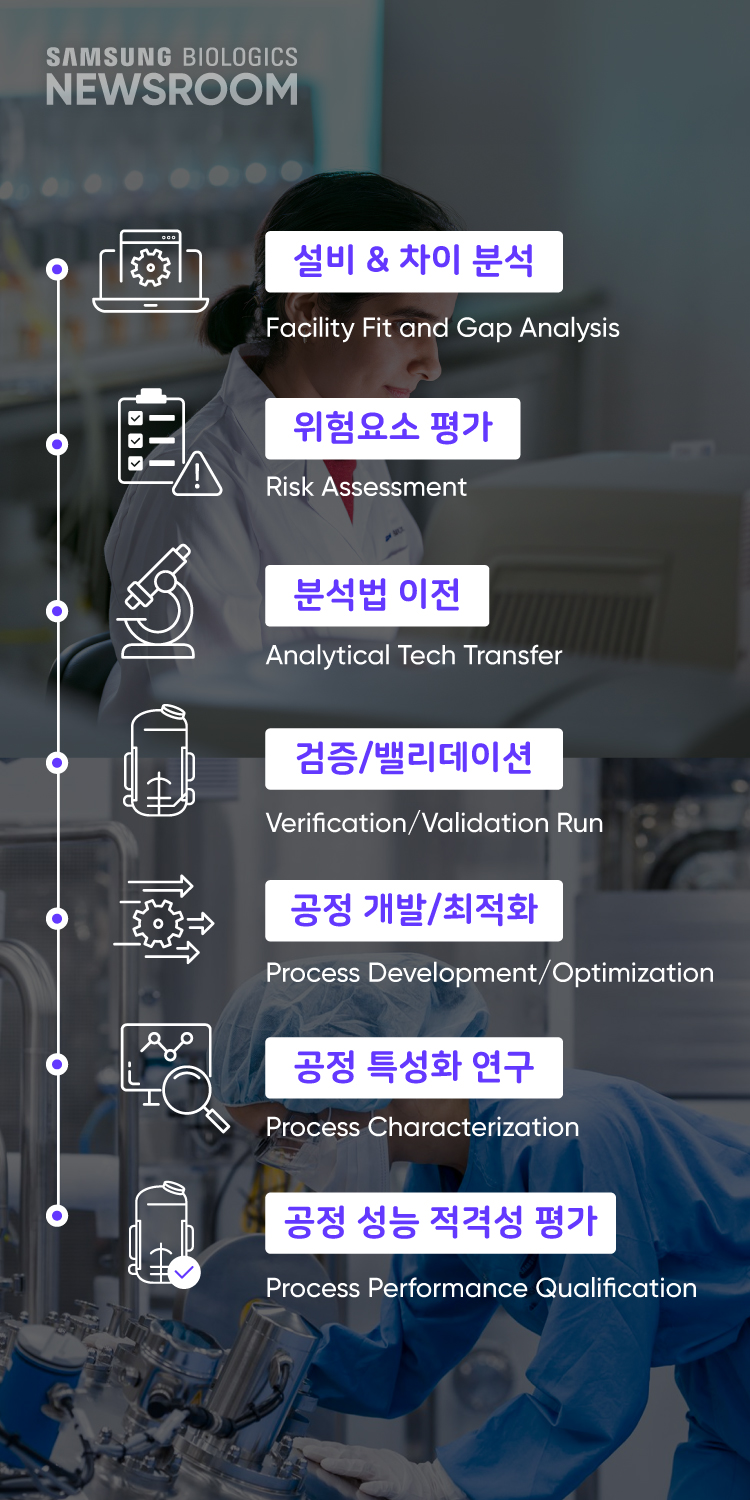
- 설치 차이 분석 Facility Fit and Gap Analysis
- 위험요소 평가 Risk Assessment
- 분석법 이전 Analytical Tech Transfer
- 검증/밸리데이션 Verification / Validation Run
- 공정 개발/최적화 Process Development/ Optimization
- 공정 특성화 연구 Process Characterization
- 공정 성능 적격성 Process Performance Qualification
원활한 동기화를 위해서는 먼저 ‘차이 분석(Gap Analysis)’이 필요합니다. 생산 설비, 공정 절차, 사용하는 원료 등 의약품 생산현장의 온도부터 공정별 소요시간까지 약 180가지 이상의 요소를 다각적으로 분석하는데, 이렇게 파악한 모든 차이는 문서로 기록되어 기술 이전 절차의 뼈대가 됩니다. 제약사와 CDMO간 설비 옵션의 간극이 크면 새로운 설비를 도입하기도 하고, 초기에 필요한 원자재를 신속하게 조달해 리드타임을 최소화하기도 하죠.
이후 위험요소 평가, 분석법 이전, 검증/밸리데이션 운전, 공정 특성화 연구를 거쳐, 총 4차례 이상의 공정 성능 적격성 평가까지 통과하면 본격적인 상업 생산에 도입할 청사진이 완성됩니다.
이유 있는 신속함,
시스템과 프로세스 혁신
제약사가 위탁한 바이오의약품을 시장에 빠르게 출시하기 위해서는 기술 이전 단계부터 상업 생산 단계까지 모든 과정을 감안해 계획을 수립하고 위험요소를 철저하게 관리해야 합니다.
삼성바이오로직스는 단일 사이트 기준 세계 최대 규모의 항체 기반 바이오의약품 생산 시설에서 100여개 넘는 전세계 고객사와 함께 프로젝트를 진행하며 축적한 생산 노하우를 기반으로 기술이전 절차를 표준화 했습니다. 특히 삼성바이오로직스의 ‘품질 위험요소 관리 시스템(Quality Risk Management System)’에 따라 모든 위험요소를 점수로 집계하는데, 일정 점수 이상의 고위험군으로 판단되면 전담팀을 추가로 구성합니다. 기술 이전에 영향을 미칠 수 있는 위험요소를 미리 찾아 체계적으로 관리하는 것이죠.

또한 FDA, EMA 외 각국 규제기관의 다양한 품질 기준을 맞추면서 쌓은 전문성으로 최신 규제 동향을 반영한 전략을 제시하고, 고객 맞춤형 추가 연구 옵션인 ‘프리미엄 애드온(add-on) 서비스’ 도입, 데이터 관리를 위한 디지털 기술 접목 등 프로세스 혁신을 이어가고 있습니다.
데이터 보호, 기술 이전의 핵심으로 부상
한편, 기술 이전 과정에서는 영업 비밀이나 환자 데이터 등과 같은 주요 정보가 다뤄지는 만큼 신속한 기술 이전의 핵심 요소로 ‘정보 보호’가 부상하고 있습니다. 미국 보건복지부(HHS)가 발표한 바이오 기업의 사이버위협 관련 보고서에 따르면 헬스케어 분야의 사이버 위협은 전체 해킹의 24.5%를 차지하며, 데이터 유출로 인한 평균 손해 비용은 500만 달러(약 68억)원에 달합니다.
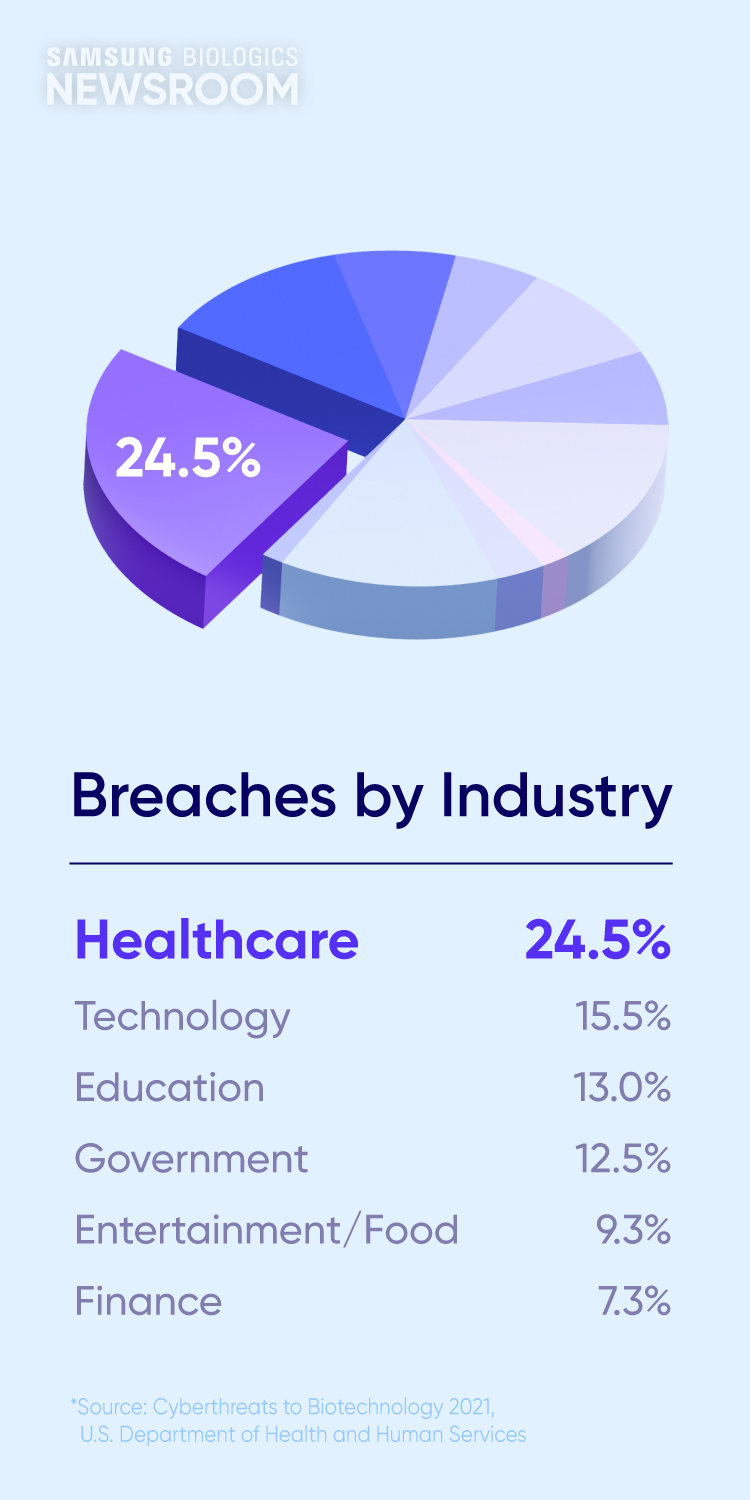
Breaches by Industry
- Healthcare 24.5%
- Technology 15.5%
- Education 13.0%
- Government 12.5%
- Entertainment/Food 9.3%
- Finance 7.3%
삼성바이오로직스는 CDMO 기업 최초로 지난 2019년 정보보호 국제표준 인증인 ISO 27001을 획득한 데 이어, 2022년에는 ISO 27017(클라우드 보안) 인증을 추가 획득하며 글로벌 최고 수준의 보안관리체계를 갖추고 지적 재산권과 데이터 보호에 힘쓰고 있습니다.
바이오 업계의 성장에 따라 사이버 보안 이슈가 증가하고, 각국 정부와 글로벌 규제기관의 데이터 보호 기조가 강화되면서 사이버 보안과 정보 보호 관련 기준도 갈수록 심화될 것으로 예측됩니다.
완벽함에 신속함을 더하는, 이유 있는 신뢰 관계.
삼성바이오로직스의 기술 이전 노하우를 더 자세히 알고 싶다면, 다음 백서를 확인해보세요. 😊
관련 콘텐츠
Whitepapers Streamlining single-use assemblies in the bulk-fill step of downstream processing
Samsung BIO Insight 글로벌 빅파마와의 파트너십, 세계 최대 생산시설에서 신뢰를 스케일업(Scale Up)하다
- CDO
- CGMP
- ADC
- Bio Campus
- IR
- CMO
Share article
