보도자료
삼성바이오로직스 경쟁력 집중탐구: 바이오의약품 위탁생산(CMO)이 궁금해

삼성바이오로직스 경쟁력 집중탐구
바이오의약품 위탁생산이 궁금해?
Contract Manufacturing Organization
글로벌 바이오의약품 시장 규모가 확대되면서 ‘위탁생산(CMO)’에 대한 관심도 높아지고 있습니다. 바이오의약품을 개발한 제약사에서 직접 생산하지 않고 위탁하는 이유는 무엇일까요? 바이오의약품 위탁생산이란 무엇이고, 삼성바이오로직스 CMO 서비스의 경쟁력은 무엇인지에 대해 살펴보며, 바이오의약품 위탁생산에 대한 궁금증을 해소해드립니다.
‘효율성’과 ‘전문성’이 강점인 위탁생산(CMO)
제약사에서 신약 후보물질을 개발한 후, 그 약이 환자들에게 전달되기 위해서는 바이오의약품의 원활한 생산이 뒷받침되어야 합니다. 즉, 바이오의약품의 ‘대량 생산’이 가능해야만 최종적으로 전 세계의 환자들이 그 약의 효능을 누릴 수 있는 것이죠. 그러나 바이오의약품은 살아있는 세포로 만드는 만큼 제조 및 품질 관리 과정이 매우 까다롭기 때문에, 각국 규제 기관의 인허가 기준을 충족하고 GMP(Good Manufacturing Practice)에 맞는 생산 시설을 확보하는 일은 또 하나의 중요한 과제입니다.
(*바이오의약품이 궁금하다면? '바이오의약품이란 무엇인가요' 기사 읽으러 가기)
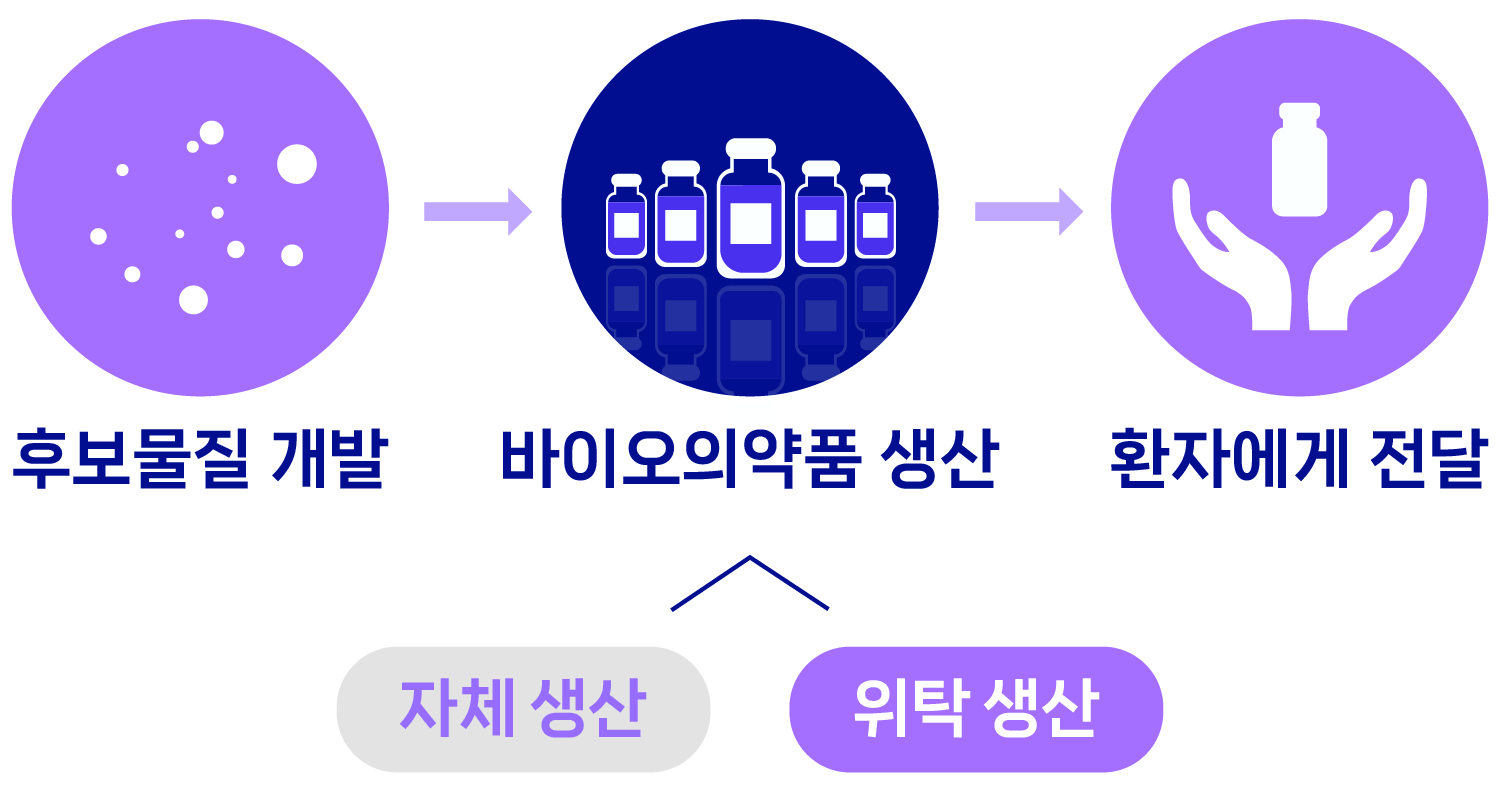
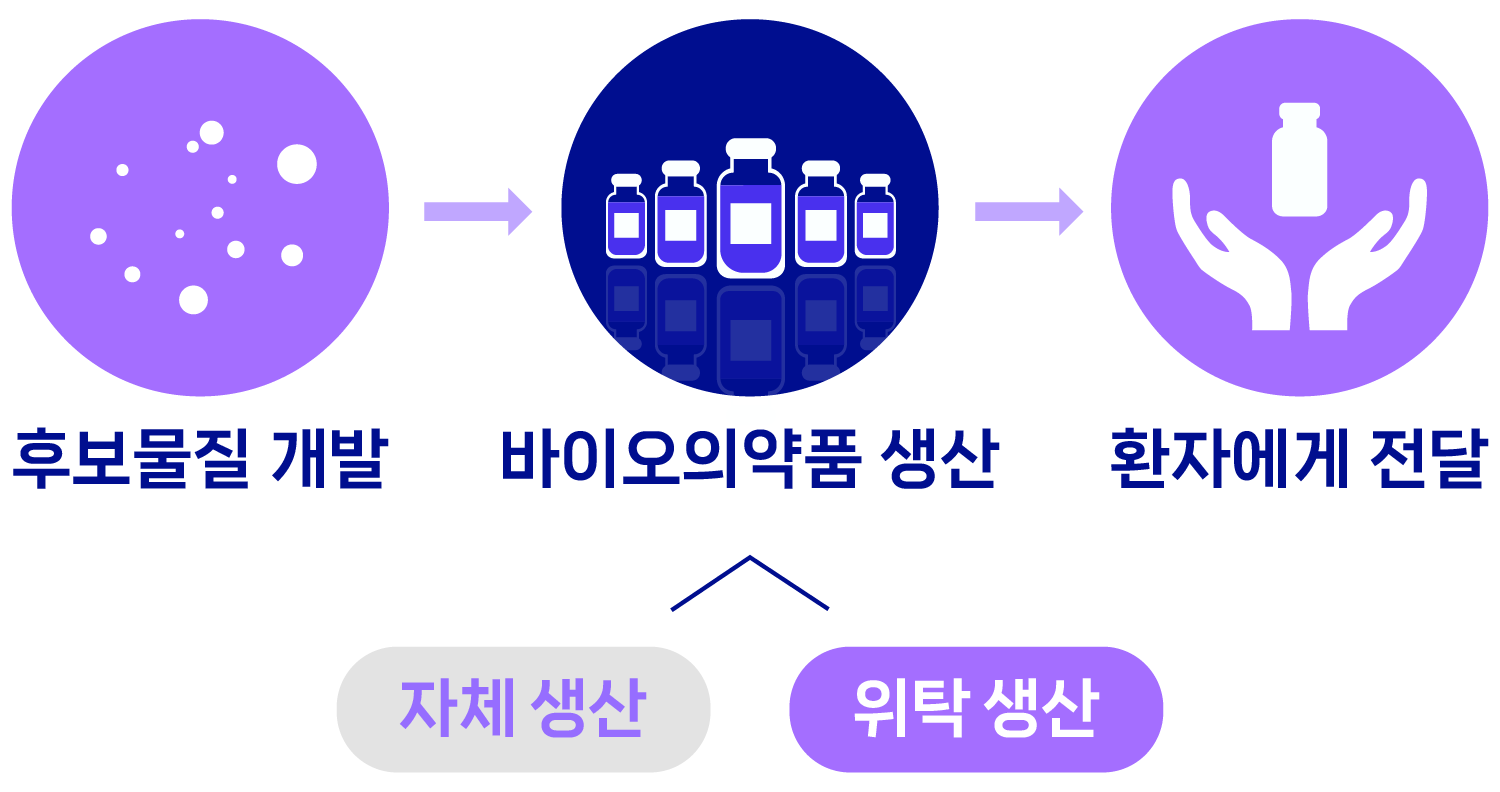
- 후보물질 개발
- 바이오의약품 생산
- 자체생산
- 위탁생산
- 환자에게 전달
바이오의약품 위탁생산(CMO:Contract Manufacturing Organization)은 이처럼 바이오의약품을 고객사로부터 의뢰받아 ‘위탁 생산’하는 사업입니다. 글로벌 제약사들이 자체 보유하고 있는 생산 시설에서 모든 약을 신속하게 생산하기 어렵고, 자체 생산 역량이 부족하거나 생산 시설이 없는 글로벌 바이오테크나 제약사도 있기 때문에 바이오의약품 위탁생산에 대한 수요는 점차 증가하고 있습니다.
또한 바이오의약품 시장이 지속 성장함에 따라 글로벌 제약사들이 막대한 투자가 필요한 생산 설비 증설 대신 연구개발과 마케팅에 집중하는 전략을 구사하고, 공급 안정성 확보를 위해 생산 시설을 복수로 분산시키는 것도 위탁생산 수요가 증가하는 원인 중 하나입니다. 프로스트 & 설리번(Frost & Sullivan)에 따르면 글로벌 CMO 시장은 연평균 13.7% 성장해 2025년에는 253억 달러(약 28조)를 기록할 전망입니다.
바이오의약품의 성공적인 생산을 위한 여정
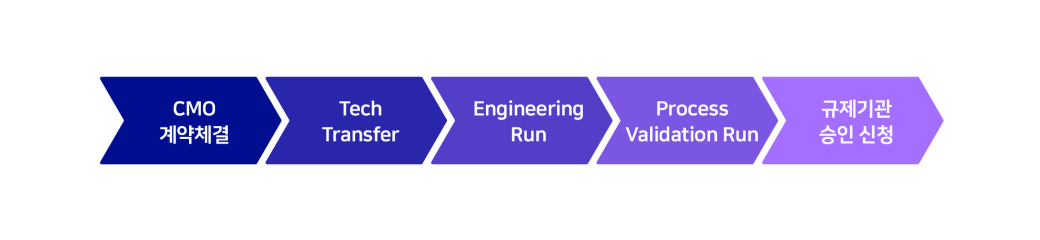
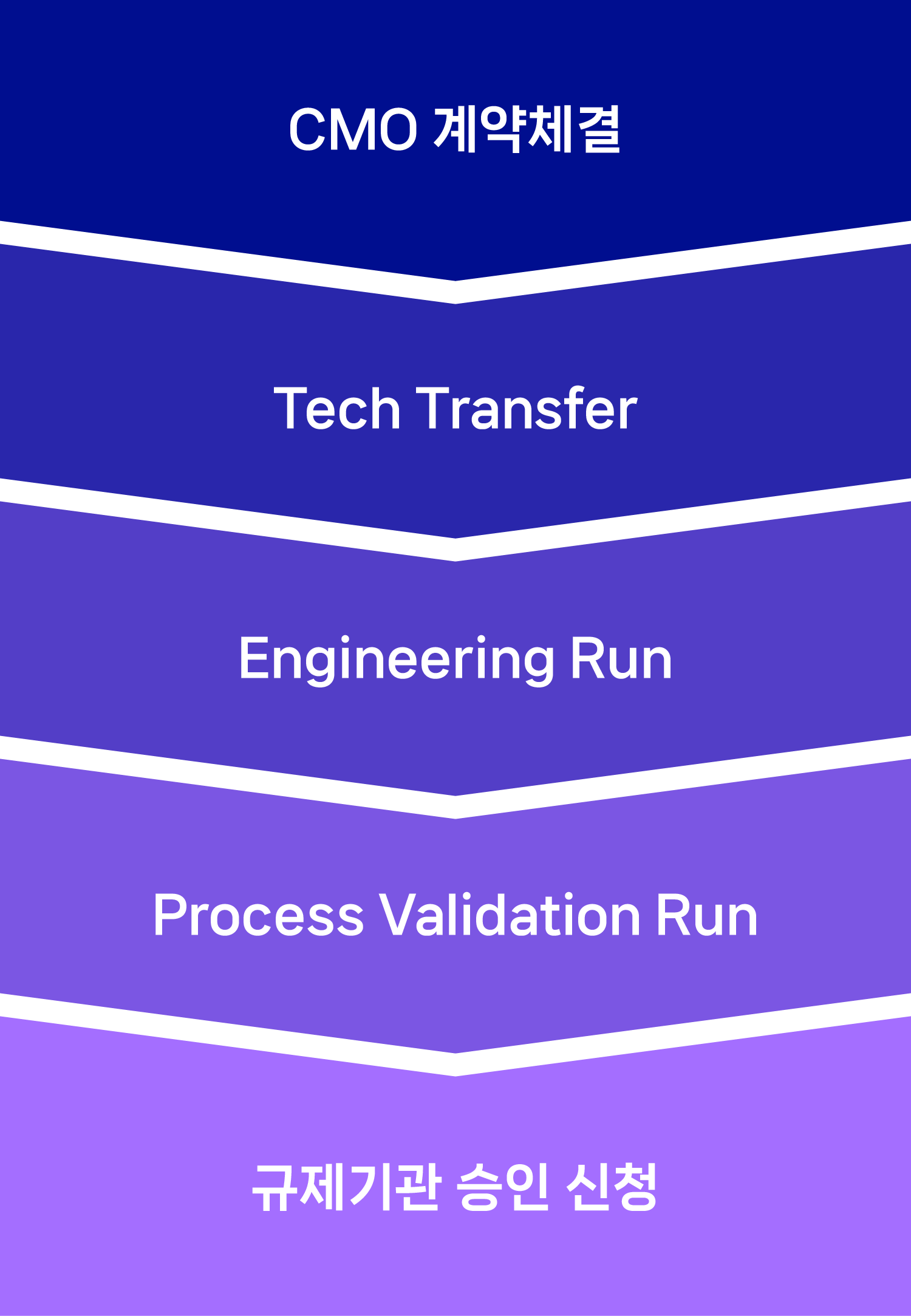
- CMO 계약체결
- Tech Transfer
- Engineering
- Process Validation Run
- 규제기관 승인 신청
고객사와 위탁생산(CMO) 계약을 체결하고 나면 바이오의약품의 성공적인 생산을 위한 긴 여정이 시작됩니다. 먼저 ‘기술 이전(Tech Transfer)’ 단계로, 고객사에서 개발한 바이오의약품을 생산하기 위해 해당 의약품의 공정, 분석법, 시험법 등의 기술을 이전하는 절차를 진행합니다. 이후 ‘엔지니어링 런(Engineering Run)’과 ‘공정 밸리데이션 런(Process Validation Run)’을 통해 생산공정 변수와 설비 등을 최적화시키고, 단계별로 시험 생산하며 바이오의약품의 안정성 검증을 진행합니다. 이렇게 자체 생산 준비 과정을 마치고 난 후에야 국제 규제기관(FDA, EMA 등)에 인증용 생산제품과 생산공정에 대한 제조 승인을 신청할 수 있습니다.
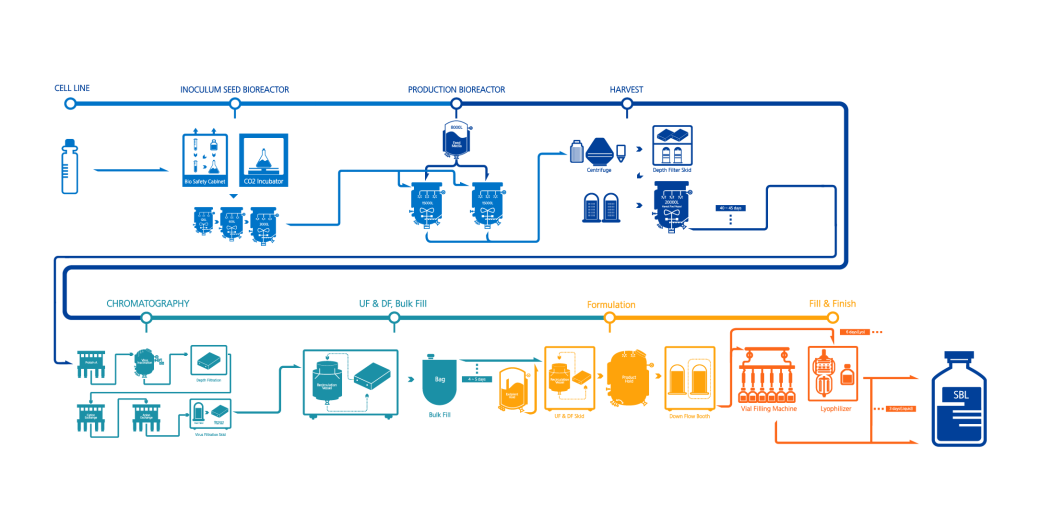
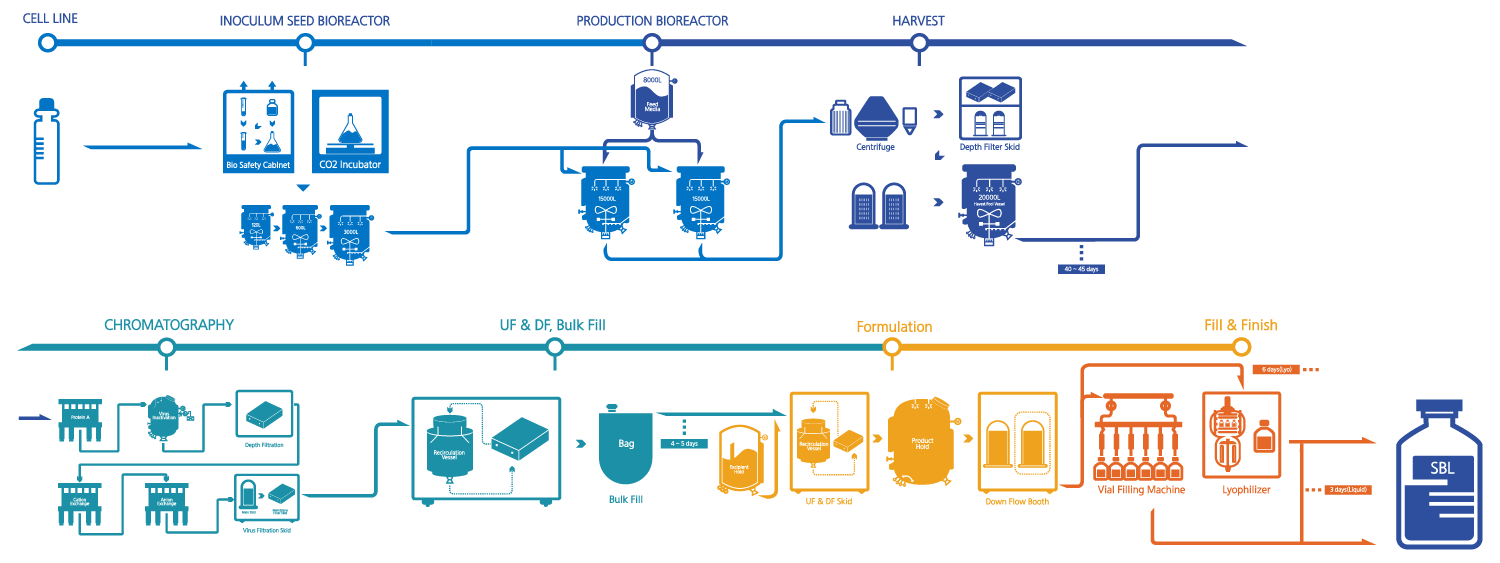
- CELL LINE
- INOCULUM SEED BIOREACTOR
- PRODUCTION BIOREACTOR
- HARVEST
- CHROMATOGRAPHY
- UF & DF, Bulk Fill
- Formulation
- Fill & Finish
제조 승인을 받은 후에는 본격적으로 대량 생산에 들어가게 됩니다. ‘배양(Cell Culture)’ 공정에서 고품질의 목적 단백질을 생산하고, ‘정제(Purification)’ 공정에서 원하는 항체만을 추출해 원료의약품(DS: Drug Substance)을 생산하고 나면, ‘무균 충전(Aseptic Fill)’ 공정을 거쳐 비로소 환자에게 제공될 수 있는 완제의약품(DP: Drug Product)으로 거듭나게 되는 것이죠. 이때 모든 생산 과정은 각국의 GMP를 엄격히 준수해 이뤄집니다.
삼성바이오로직스의 CMO 경쟁력은?
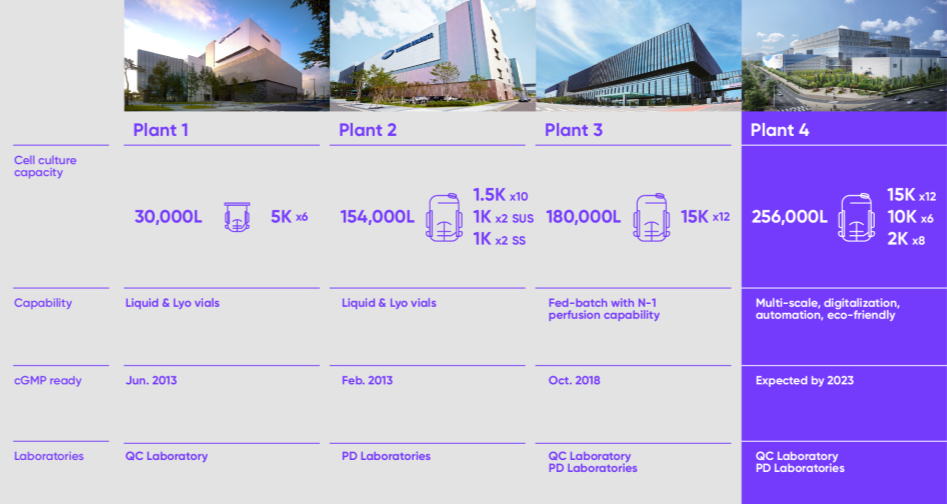
인천 송도에 위치한 삼성바이오로직스는 36만 4천 리터의 세계 최대 규모의 바이오의약품 생산 시설을 자랑합니다. 오는 2023년 4공장이 완공되면 총 62만 리터의 생산 능력을 갖추게 됩니다.삼성바이오로직스는 어떤 생산 단계든, 어떤 생산 규모든 고객사의 모든 요구 사항에 유연하게 대응할 수 있는 다양한 생산 설비를 갖추고 있어 고객 맞춤형 솔루션을 제공할 수 있습니다.
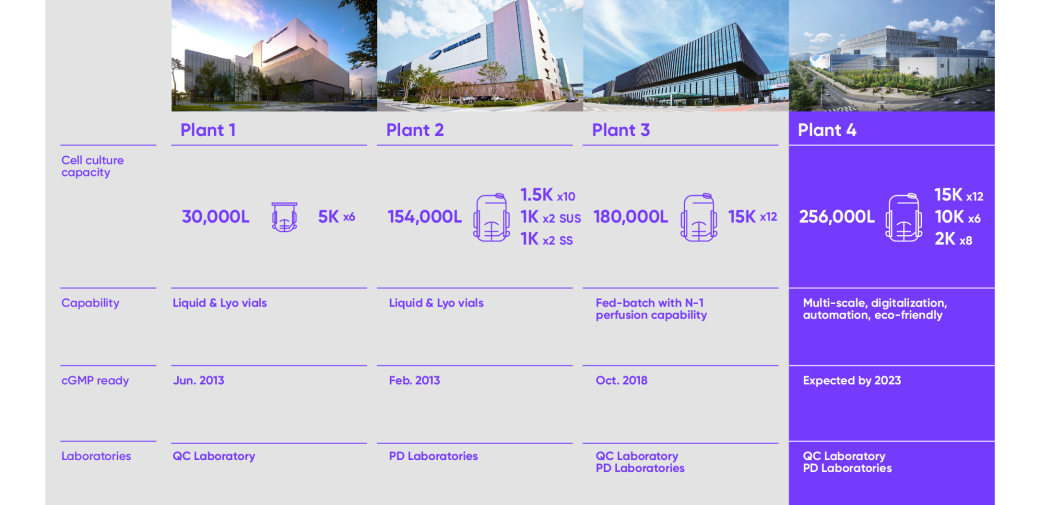
- Plant 1 Cell culture capacity 5K x 6 = 30,000L
- Plant 1 Capability Liquid & Lyo vials
- Plant 1 CGMP ready Jun. 2013
- Plant 1 Laboratories QC Laboratory
- Plant 2 Cell culture capacity (1.5K x 10) + (1K x 2 SUS) + (1K x 2 SS) = 154,000L
- Plant 2 Capability Liquid & Lyo vials
- Plant 2 CGMP ready Fed. 2013
- Plant 2 Laboratories PD Laboratories
- Plant 3 Cell culture capacity 15K x 12 = 180,000L
- Plant 3 Capabillity Fed-batch with N-1 perfusion capability
- Plant 3 CGMP ready Oct. 2018
- Plant 3 Laboratories QC Laboratory, PD Laboratories
- Plant 4 Cell culture capacity (15K x 12) + (10K + 6) + (2K + 8) = 256,000L
- Plant 4 Capabillity Multi-scale, digitalizations, automation, eco-friendly
- Plant 4 CGMP ready Expercted by. 2023
- Plant 4 Laboratories QC Laboratory, PD Laboratories
최고의 전문성을 바탕으로 최첨단 설비와 N-1 Perfusion*, EQUIS** 등의 첨단 기술로 고객 만족도를 높인 것은 물론, 2020년 초에는 코로나 상황에 선제대응하며 전 세계 어디에서나 온라인으로 접속해 진행할 수 있는 ‘실시간 가상투어 시스템(LVT: Live Virtual Tour)’을 도입해 글로벌 제약사를 비롯하여 미국 식품의약국(FDA), 유럽의약품청(EMA) 등 글로벌 규제기관과 가상 실사를 진행하며 변화하는 환경에도 능동적으로 대응하고 있습니다. 삼성바이오로직스는 단기간에 국제 인증기관으로부터 총 92건*** 의 글로벌 제조 승인을 획득하며 세계 최고 수준의 품질 경쟁력도 입증했습니다.
* N-1 Perfusion: 첨단 세포배양기술로, 제품 생산기간을 단축해 생산성을 향상시킨다.
* EQUIS(Enterprise Quality Unified Information System): 실시간으로 문서와 품질 레코드를 기록하고 관리할 수 있는 시스템.
** 총 92건: 2021년 5월 기준
또한 삼성바이오로직스는 위탁생산뿐 아니라 위탁개발(CDO)과 바이오의약품 분석 시험(Biosafety Testing)까지 포함하는 ‘원스톱 서비스’를 제공하며 편의성을 강화했습니다. 고객이 필요로 하는 모든 서비스를 삼성바이오로직스 한 곳에서 제공하기 때문에 제품 생산 기간 단축과 가격 경쟁력 확보가 가능합니다.
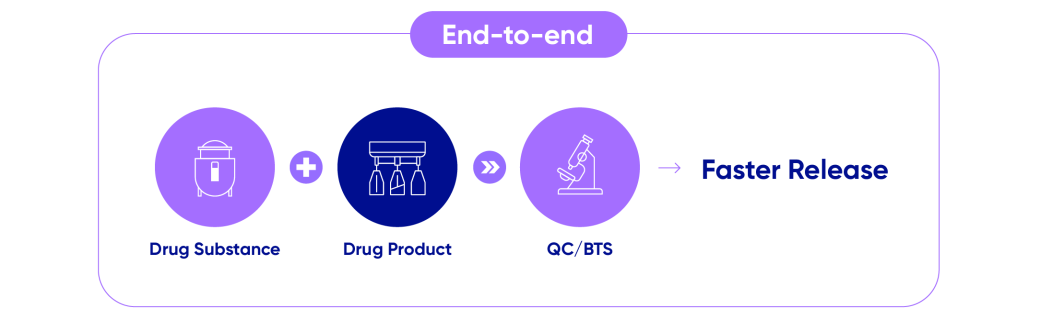
- Drug Substance
- Drug Product
- QC/BTS
- Faster Release
고객사는 단계별로 다른 업체를 찾을 필요가 없는 만큼 업체를 새로 찾을 때마다 드는 수고와 시간 지연, 기술 유출 등의 우려에서도 벗어날 수 있습니다.
끊임없는 혁신으로 새로운 길을 만들다
지난 2011년 창립 이후, 삼성바이오로직스는 끊임없는 혁신으로 고품질의 바이오의약품 생산을 위해 진화를 거듭하며, 유수의 글로벌 제약사들과 파트너십을 구축하며 업계 최고 바이오 기업으로서의 명성을 이어왔습니다. 세계적 권위의 CMO 분야 시상식인 ‘CMO 리더십 어워즈’에서 2013년 이후 매회 연속 수상하며 고객 만족과 품질 경쟁력을 인정받는 동시에, 시장 환경 변화에도 신속하게 대처하며 생산 기간 단축과 가격 경쟁력 확보를 통해 전 세계 환자들에게 희망을 선사하고 있습니다.
특히 지난해부터 코로나19 항체치료제 안정적인 생산과 공급을 통해 팬데믹 종식을 위해 힘써왔는데요, 최근에는 모더나(Moderna)와 코로나19 mRNA 백신 완제(DP: Drug Product) 위탁생산 계약을 체결하며 mRNA 백신 대량 생산이 가능하도록 완제 시설을 보완 및 확충했습니다. 삼성바이오로직스는 이번 mRNA 백신 완제 공정을 시작으로, 오는 2022년 중반까지 mRNA 백신 원료(DS: Drug Substance) 공정 준비를 완료해 ‘아시아 백신 허브’ 도약을 전면 지원할 계획입니다.
우수한 기술력과 품질, 속도 경쟁력을 앞세워 인류 건강한 삶을 위해 노력하고 있는 삼성바이오로직스는 더 나은 솔루션 제공을 위해 사업 영역을 확장하고 있는데요, 다음 편에서는 삼성바이오로직스 또 다른 사업 영역인 위탁개발(CDO)에 대해 소개하도록 하겠습니다.

글로벌 바이오의약품 시장 규모가 확대되면서 ‘위탁생산(CMO)’에 대한 관심도 높아지고 있습니다. 바이오의약품을 개발한 제약사에서 직접 생산하지 않고 위탁하는 이유는 무엇일까요? 바이오의약품 위탁생산이란 무엇이고, 삼성바이오로직스 CMO 서비스의 경쟁력은 무엇인지에 대해 살펴보며, 바이오의약품 위탁생산에 대한 궁금증을 해소해드립니다.
‘효율성’과 ‘전문성’이 강점인 위탁생산(CMO)
제약사에서 신약 후보물질을 개발한 후, 그 약이 환자들에게 전달되기 위해서는 바이오의약품의 원활한 생산이 뒷받침되어야 합니다. 즉, 바이오의약품의 ‘대량 생산’이 가능해야만 최종적으로 전 세계의 환자들이 그 약의 효능을 누릴 수 있는 것이죠. 그러나 바이오의약품은 살아있는 세포로 만드는 만큼 제조 및 품질 관리 과정이 매우 까다롭기 때문에, 각국 규제 기관의 인허가 기준을 충족하고 GMP(Good Manufacturing Practice)에 맞는 생산 시설을 확보하는 일은 또 하나의 중요한 과제입니다.
(*바이오의약품이 궁금하다면? '바이오의약품이란 무엇인가요' 기사 읽으러 가기)
바이오의약품 위탁생산(CMO:Contract Manufacturing Organization)은 이처럼 바이오의약품을 고객사로부터 의뢰받아 ‘위탁 생산’하는 사업입니다. 글로벌 제약사들이 자체 보유하고 있는 생산 시설에서 모든 약을 신속하게 생산하기 어렵고, 자체 생산 역량이 부족하거나 생산 시설이 없는 글로벌 바이오테크나 제약사도 있기 때문에 바이오의약품 위탁생산에 대한 수요는 점차 증가하고 있습니다.
또한 바이오의약품 시장이 지속 성장함에 따라 글로벌 제약사들이 막대한 투자가 필요한 생산 설비 증설 대신 연구개발과 마케팅에 집중하는 전략을 구사하고, 공급 안정성 확보를 위해 생산 시설을 복수로 분산시키는 것도 위탁생산 수요가 증가하는 원인 중 하나입니다. 프로스트 & 설리번(Frost & Sullivan)에 따르면 글로벌 CMO 시장은 연평균 13.7% 성장해 2025년에는 253억 달러(약 28조)를 기록할 전망입니다.
바이오의약품의 성공적인 생산을 위한 여정
고객사와 위탁생산(CMO) 계약을 체결하고 나면 바이오의약품의 성공적인 생산을 위한 긴 여정이 시작됩니다. 먼저 ‘기술 이전(Tech Transfer)’ 단계로, 고객사에서 개발한 바이오의약품을 생산하기 위해 해당 의약품의 공정, 분석법, 시험법 등의 기술을 이전하는 절차를 진행합니다. 이후 ‘엔지니어링 런(Engineering Run)’과 ‘공정 밸리데이션 런(Process Validation Run)’을 통해 생산공정 변수와 설비 등을 최적화시키고, 단계별로 시험 생산하며 바이오의약품의 안정성 검증을 진행합니다. 이렇게 자체 생산 준비 과정을 마치고 난 후에야 국제 규제기관(FDA, EMA 등)에 인증용 생산제품과 생산공정에 대한 제조 승인을 신청할 수 있습니다.
제조 승인을 받은 후에는 본격적으로 대량 생산에 들어가게 됩니다. ‘배양(Cell Culture)’ 공정에서 고품질의 목적 단백질을 생산하고, ‘정제(Purification)’ 공정에서 원하는 항체만을 추출해 원료의약품(DS: Drug Substance)을 생산하고 나면, ‘무균 충전(Aseptic Fill)’ 공정을 거쳐 비로소 환자에게 제공될 수 있는 완제의약품(DP: Drug Product)으로 거듭나게 되는 것이죠. 이때 모든 생산 과정은 각국의 GMP를 엄격히 준수해 이뤄집니다.
삼성바이오로직스의 CMO 경쟁력은?
인천 송도에 위치한 삼성바이오로직스는 36만 4천 리터의 세계 최대 규모의 바이오의약품 생산 시설을 자랑합니다. 오는 2023년 4공장이 완공되면 총 62만 리터의 생산 능력을 갖추게 됩니다.삼성바이오로직스는 어떤 생산 단계든, 어떤 생산 규모든 고객사의 모든 요구 사항에 유연하게 대응할 수 있는 다양한 생산 설비를 갖추고 있어 고객 맞춤형 솔루션을 제공할 수 있습니다.
최고의 전문성을 바탕으로 최첨단 설비와 N-1 Perfusion*, EQUIS** 등의 첨단 기술로 고객 만족도를 높인 것은 물론, 2020년 초에는 코로나 상황에 선제대응하며 전 세계 어디에서나 온라인으로 접속해 진행할 수 있는 ‘실시간 가상투어 시스템(LVT: Live Virtual Tour)’을 도입해 글로벌 제약사를 비롯하여 미국 식품의약국(FDA), 유럽의약품청(EMA) 등 글로벌 규제기관과 가상 실사를 진행하며 변화하는 환경에도 능동적으로 대응하고 있습니다. 삼성바이오로직스는 단기간에 국제 인증기관으로부터 총 92건*** 의 글로벌 제조 승인을 획득하며 세계 최고 수준의 품질 경쟁력도 입증했습니다.
* N-1 Perfusion: 첨단 세포배양기술로, 제품 생산기간을 단축해 생산성을 향상시킨다.
* EQUIS(Enterprise Quality Unified Information System): 실시간으로 문서와 품질 레코드를 기록하고 관리할 수 있는 시스템.
** 총 92건: 2021년 5월 기준
또한 삼성바이오로직스는 위탁생산뿐 아니라 위탁개발(CDO)과 바이오의약품 분석 시험(Biosafety Testing)까지 포함하는 ‘원스톱 서비스’를 제공하며 편의성을 강화했습니다. 고객이 필요로 하는 모든 서비스를 삼성바이오로직스 한 곳에서 제공하기 때문에 제품 생산 기간 단축과 가격 경쟁력 확보가 가능합니다.
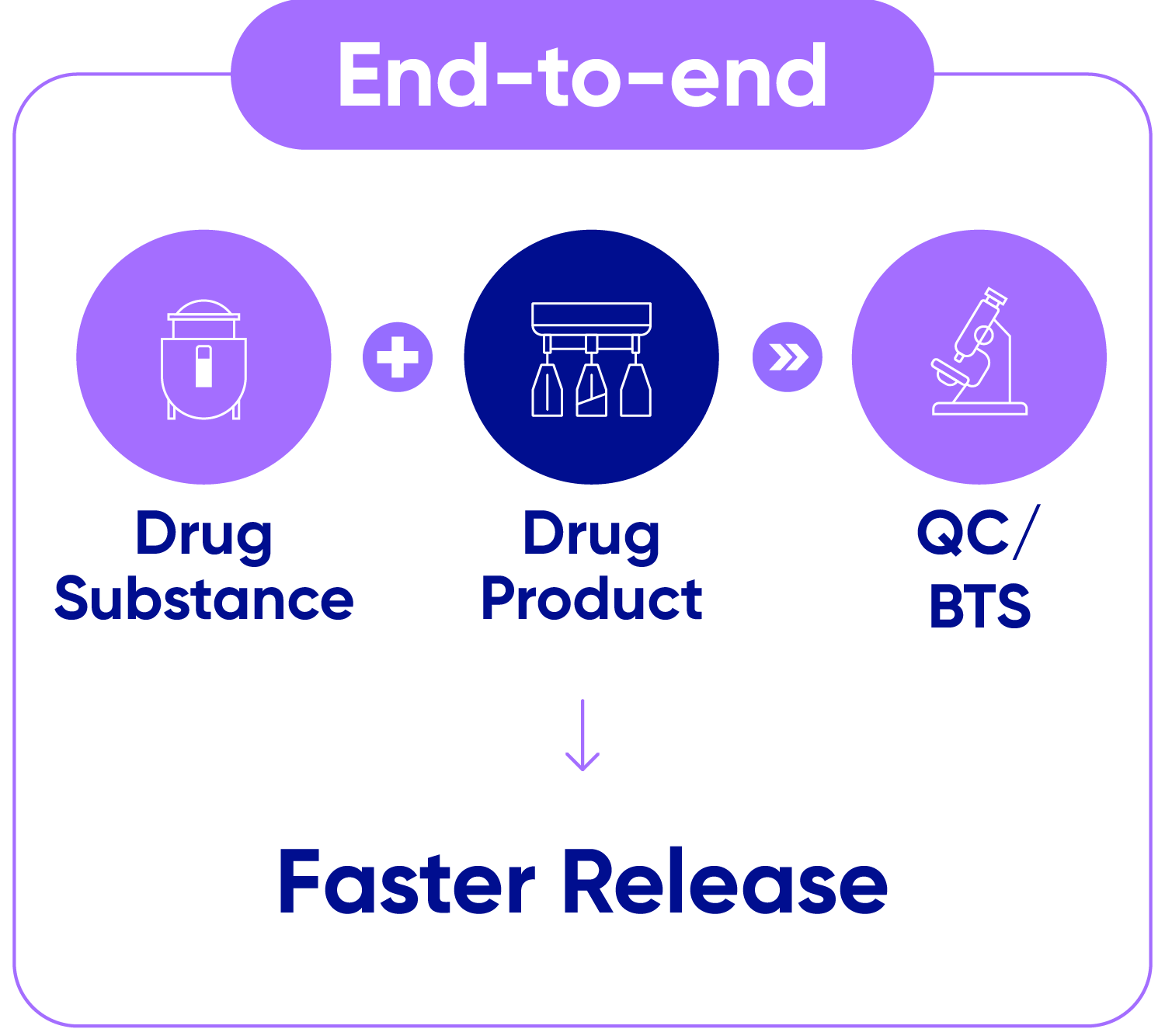
고객사는 단계별로 다른 업체를 찾을 필요가 없는 만큼 업체를 새로 찾을 때마다 드는 수고와 시간 지연, 기술 유출 등의 우려에서도 벗어날 수 있습니다.
끊임없는 혁신으로 새로운 길을 만들다
지난 2011년 창립 이후, 삼성바이오로직스는 끊임없는 혁신으로 고품질의 바이오의약품 생산을 위해 진화를 거듭하며, 유수의 글로벌 제약사들과 파트너십을 구축하며 업계 최고 바이오 기업으로서의 명성을 이어왔습니다. 세계적 권위의 CMO 분야 시상식인 ‘CMO 리더십 어워즈’에서 2013년 이후 매회 연속 수상하며 고객 만족과 품질 경쟁력을 인정받는 동시에, 시장 환경 변화에도 신속하게 대처하며 생산 기간 단축과 가격 경쟁력 확보를 통해 전 세계 환자들에게 희망을 선사하고 있습니다.
특히 지난해부터 코로나19 항체치료제 안정적인 생산과 공급을 통해 팬데믹 종식을 위해 힘써왔는데요, 최근에는 모더나(Moderna)와 코로나19 mRNA 백신 완제(DP: Drug Product) 위탁생산 계약을 체결하며 mRNA 백신 대량 생산이 가능하도록 완제 시설을 보완 및 확충했습니다. 삼성바이오로직스는 이번 mRNA 백신 완제 공정을 시작으로, 오는 2022년 중반까지 mRNA 백신 원료(DS: Drug Substance) 공정 준비를 완료해 ‘아시아 백신 허브’ 도약을 전면 지원할 계획입니다.
우수한 기술력과 품질, 속도 경쟁력을 앞세워 인류 건강한 삶을 위해 노력하고 있는 삼성바이오로직스는 더 나은 솔루션 제공을 위해 사업 영역을 확장하고 있는데요, 다음 편에서는 삼성바이오로직스 또 다른 사업 영역인 위탁개발(CDO)에 대해 소개하도록 하겠습니다.