보도자료

표적 세포를 공격해 높은 치료 효과를 보이는 항체 의약품. 1986년 세계 최초의 항체 신약 무로모납(muromonab) 탄생 이래 지속적으로 그 종류와 수가 확대되며 40여년이 지난 지금까지도 암, 면역 질환과 같은 주요 질병의 치료제로 활약하고 있습니다.
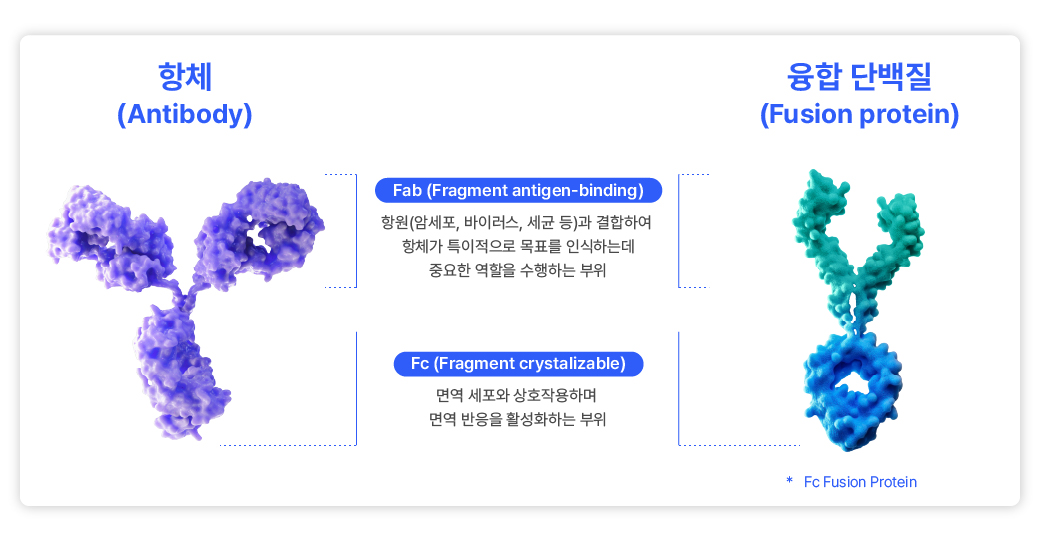
항체의약품이 상용화되면서 유전자 재조합 기술을 활용한 융합 단백질(fusion protein)도 함께 발전했습니다. 융합 단백질은 두 개 이상의 서로 다른 단백질을 결합해 하나의 단백질로 만든 치료제로, 표적 세포(항원)와 결합하는 항체 기능에 추가 기능을 더해 치료 효과를 개선한 의약품입니다.
한 개의 융합 단백질로 재탄생한 조각들
바이오의약품 업계에서 일컫는 융합 단백질은 대개 치료용 의약품으로 사용되는 Fc 융합 단백질(Fc fusion protein)로, 항체의 Fc 영역에 치료 단백질을 결합한 형태를 말합니다. 약물이 몸에서 머무르는 시간인 체내 반감기를 연장하거나, 서로 다른 표적에 결합 가능한 도메인을 융합하는 등 기능을 추가해 다양하고 복합적인 치료 효과를 나타내지만, 항체 의약품 대비 구조적으로 불안정하다는 특성을 지닙니다.
구조적 불안정성으로 인해 융합 단백질 개발에는 상대적으로 더 많은 시간과 노력이 투입됩니다. 항체 의약품은 수십 년에 걸쳐 수많은 작용 기전과 효율적인 생산 과정이 개발되었지만, 융합 단백질은 가지각색으로 변형된 구조에 따라 세상에 없던 새로운 작용 기전을 밝혀내면서 동시에 가장 안정적으로 생산될 수 있는 최적의 조건을 새로 찾아야 하기 때문입니다.
새로 그리는 융합 단백질 개발 지도
융합 단백질의 불안정한 구조는 단백질의 발현과 정제 과정에서 손실을 일으킬 수 있고, 이는 곧 생산 효율 감소로 이어지기 때문에 개발 단계에서부터 공정 최적화가 필요합니다.
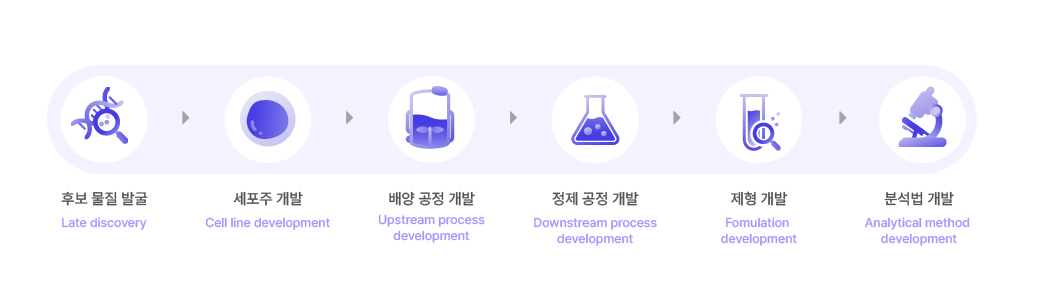
후보물질 발굴, 세포주 개발, 배양, 정제, 제형 개발 순서로 이뤄지는 의약품 개발 공정.
매 단계마다 물질의 안정성과 품질을 평가하기 위한 분석 시험이 함께 진행된다.
예를 들어 후보 물질 발굴 단계에서는 과당화(hyper glycosylation)처럼 융합 단백질만이 가진 위험 요소를 사전에 파악하고, 세포주 개발 단계에서는 생산성이 높은 클론(Clone: 최적 단일 세포)의 발견 확률을 높이기 위해 항체 의약품 대비 더 많은 백업 플레이트를 준비해 최대한 다양한 후보군을 확보합니다.
또한 융합 단백질의 구조적 불안정성은 의약품의 안전성과 효능에도 영향을 미치기에 더 많은 분석 시험을 수행해야 합니다. 삼성바이오로직스 김윤식 프로(분석MD파트)는 “융합 단백질은 항체 의약품 대비 안정성과 약효를 증명하기 위한 추가적인 분석 시험이 요구되기에 ‘전이 효소 시스템(transposase system)’을 활용하면 충분한 양의 시료를 확보하는 동시에 타임라인 단축도 기대할 수 있다”고 설명하며 “삼성바이오로직스는 프로젝트에 따라 고객사가 전이 효소 활용을 선택할 수 있도록 옵션을 제공한다”고 덧붙였습니다.

“물질 특성에 따라 공정 개발이 달라지므로 특성을 면밀히 고려해 최적화된 공정을 설계해야 생산 효율성과 최종 제품의 품질을 높일 수 있습니다.” 최봉규 파트장(단일항체정제파트)는 융합 단백질 공정 개발의 특징을 소개하며 “특히 융합 단백질은 두 개 이상의 단백질 도메인이 결합되어 형성되기에 각 도메인의 상호작용과 구조적 안정성이 복잡해 비정상적인 폴딩이나 응집체 형성이 발생할 수 있고, 물질 특성에 따라 적합한 정제 방법이 달라서 친화성 크로마토그래피, 이온 교환 크로마토그래피 등 여러 정제 기술을 조합해야 하므로 정제 과정의 복잡성이 높은 편”이라고 설명했습니다.
플랫폼 기술로 그리는 성공 로드맵
지난 해 기준 의약품 모달리티 별 삼성바이오로직스가 수행한 의약품 개발 프로젝트는 단일클론항체(60%), 이중항체(20%), 융합단백질(14%)이 순서대로 차지했습니다. 단일 항체 의약품은 물론, 새로운 모달리티의 프로젝트도 지속적으로 축적하며 저마다 다른 특성의 후보 물질을 개발하기 위한 데이터 베이스를 보유하고 있습니다.
융합 단백질 시장 규모는 *연평균 12% 성장해 2023년 240억달러에서 2030년 550억 달러로 성장할 전망으로, 현재 전 세계에 개발 중인 융합 단백질 의약품 중 56%가 전임상 개발(preclinical) 단계에 있습니다. 융합 단백질은 개별 물질의 특성이 항체치료제 대비 매우 다양하기 때문에 각 특성에 맞는 최적화된 공정 설계를 위한 기술력이 요구됩니다.
* Source: Global data

삼성바이오로직스가 보유한 플랫폼 기술 현황
삼성바이오로직스는 DEVELOPICK™, S-Glyn™, S-OptiCharge™ 등의 자체 플랫폼 기술을 융합 단백질 개발에 적용하고, 융합 단백질 대량 생산 경험을 바탕으로 개발에서 생산까지 원활한 서비스를 제공하며 높은 생산성과 품질을 더욱 강화할 방침입니다.
관련 콘텐츠
Samsung BIO Insight 삼성바이오로직스, 고농도 제형 개발 플랫폼 '에스-하이콘' 공개
Samsung BIO Insight 스케일 업(Scale up), 다중 항체
Press Release 삼성바이오로직스, 美 BPI서 CDO 신규플랫폼 공개

표적 세포를 공격해 높은 치료 효과를 보이는 항체 의약품. 1986년 세계 최초의 항체 신약 무로모납(muromonab) 탄생 이래 지속적으로 그 종류와 수가 확대되며 40여년이 지난 지금까지도 암, 면역 질환과 같은 주요 질병의 치료제로 활약하고 있습니다.
항체의약품이 상용화되면서 유전자 재조합 기술을 활용한 융합 단백질(fusion protein)도 함께 발전했습니다. 융합 단백질은 두 개 이상의 서로 다른 단백질을 결합해 하나의 단백질로 만든 치료제로, 표적 세포(항원)와 결합하는 항체 기능에 추가 기능을 더해 치료 효과를 개선한 의약품입니다.
한 개의 융합 단백질로 재탄생한 조각들
바이오의약품 업계에서 일컫는 융합 단백질은 대개 치료용 의약품으로 사용되는 Fc 융합 단백질(Fc fusion protein)로, 항체의 Fc 영역에 치료 단백질을 결합한 형태를 말합니다. 약물이 몸에서 머무르는 시간인 체내 반감기를 연장하거나, 서로 다른 표적에 결합 가능한 도메인을 융합하는 등 기능을 추가해 다양하고 복합적인 치료 효과를 나타내지만, 항체 의약품 대비 구조적으로 불안정하다는 특성을 지닙니다.

구조적 불안정성으로 인해 융합 단백질 개발에는 상대적으로 더 많은 시간과 노력이 투입됩니다. 항체 의약품은 수십 년에 걸쳐 수많은 작용 기전과 효율적인 생산 과정이 개발되었지만, 융합 단백질은 가지각색으로 변형된 구조에 따라 세상에 없던 새로운 작용 기전을 밝혀내면서 동시에 가장 안정적으로 생산될 수 있는 최적의 조건을 새로 찾아야 하기 때문입니다.
새로 그리는 융합 단백질 개발 지도
융합 단백질의 불안정한 구조는 단백질의 발현과 정제 과정에서 손실을 일으킬 수 있고, 이는 곧 생산 효율 감소로 이어지기 때문에 개발 단계에서부터 공정 최적화가 필요합니다.

후보물질 발굴, 세포주 개발, 배양, 정제, 제형 개발 순서로 이뤄지는 의약품 개발 공정.
매 단계마다 물질의 안정성과 품질을 평가하기 위한 분석 시험이 함께 진행된다.
예를 들어 후보 물질 발굴 단계에서는 과당화(hyper glycosylation)처럼 융합 단백질만이 가진 위험 요소를 사전에 파악하고, 세포주 개발 단계에서는 생산성이 높은 클론(Clone: 최적 단일 세포)의 발견 확률을 높이기 위해 항체 의약품 대비 더 많은 백업 플레이트를 준비해 최대한 다양한 후보군을 확보합니다.
또한 융합 단백질의 구조적 불안정성은 의약품의 안전성과 효능에도 영향을 미치기에 더 많은 분석 시험을 수행해야 합니다. 삼성바이오로직스 김윤식 프로(분석MD파트)는 “융합 단백질은 항체 의약품 대비 안정성과 약효를 증명하기 위한 추가적인 분석 시험이 요구되기에 ‘전이 효소 시스템(transposase system)’을 활용하면 충분한 양의 시료를 확보하는 동시에 타임라인 단축도 기대할 수 있다”고 설명하며 “삼성바이오로직스는 프로젝트에 따라 고객사가 전이 효소 활용을 선택할 수 있도록 옵션을 제공한다”고 덧붙였습니다.

“물질 특성에 따라 공정 개발이 달라지므로 특성을 면밀히 고려해 최적화된 공정을 설계해야 생산 효율성과 최종 제품의 품질을 높일 수 있습니다.” 최봉규 파트장(단일항체정제파트)는 융합 단백질 공정 개발의 특징을 소개하며 “특히 융합 단백질은 두 개 이상의 단백질 도메인이 결합되어 형성되기에 각 도메인의 상호작용과 구조적 안정성이 복잡해 비정상적인 폴딩이나 응집체 형성이 발생할 수 있고, 물질 특성에 따라 적합한 정제 방법이 달라서 친화성 크로마토그래피, 이온 교환 크로마토그래피 등 여러 정제 기술을 조합해야 하므로 정제 과정의 복잡성이 높은 편”이라고 설명했습니다.
플랫폼 기술로 그리는 성공 로드맵
지난 해 기준 의약품 모달리티 별 삼성바이오로직스가 수행한 의약품 개발 프로젝트는 단일클론항체(60%), 이중항체(20%), 융합단백질(14%)이 순서대로 차지했습니다. 단일 항체 의약품은 물론, 새로운 모달리티의 프로젝트도 지속적으로 축적하며 저마다 다른 특성의 후보 물질을 개발하기 위한 데이터 베이스를 보유하고 있습니다.
융합 단백질 시장 규모는 *연평균 12% 성장해 2023년 240억달러에서 2030년 550억 달러로 성장할 전망으로, 현재 전 세계에 개발 중인 융합 단백질 의약품 중 56%가 전임상 개발(preclinical) 단계에 있습니다. 융합 단백질은 개별 물질의 특성이 항체치료제 대비 매우 다양하기 때문에 각 특성에 맞는 최적화된 공정 설계를 위한 기술력이 요구됩니다.
* Source: Global data

삼성바이오로직스가 보유한 플랫폼 기술 현황
삼성바이오로직스는 DEVELOPICK™, S-Glyn™, S-OptiCharge™ 등의 자체 플랫폼 기술을 융합 단백질 개발에 적용하고, 융합 단백질 대량 생산 경험을 바탕으로 개발에서 생산까지 원활한 서비스를 제공하며 높은 생산성과 품질을 더욱 강화할 방침입니다.
관련 콘텐츠
Samsung BIO Insight 삼성바이오로직스, 고농도 제형 개발 플랫폼 '에스-하이콘' 공개
Samsung BIO Insight 스케일 업(Scale up), 다중 항체
Press Release 삼성바이오로직스, 美 BPI서 CDO 신규플랫폼 공개